
【题目】对废银合金触电材料进行分离回收既节约矿物资源,又可以减少环境污染。某废银合金触电材料含Ag、Cu、Sn等,现欲利用以下工艺流程回收其中的金属资源。

回答下列问题:
(1)“加热溶解”时Cu发生的离子方程式为_________。
(2)“加热溶解”时温度常控制在50℃左右,温度不宜过高也不宜过低的原因为_________。
(3)“酸溶解”过程中会产生少量遇空气变为红棕色的无色气体,则“酸溶解”过程主要的化学方程式为_____________。
(4)常温下,Cu2+/Sn4+混合液中c(Cu3+)=0.022mol·L-1,将混合液“加热搅拌”后冷却至室温,再加“尿素”调节溶液的pH范围为__________。(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
(5)检验Sn(OH)4沉淀是否洗涤干净的方法是____________。
(6)用惰性电极电解CuCl2溶液,阴极反应式是___________,若想由CuCl2溶液得到无水CuCl2固体,则需进行的实验操作为_______________。
【答案】Cu+2H++H2O2![]() Cu2++2H2O 低于50℃,溶解反应较慢,超过50℃,H2O2分解与HCl逸出导致溶解翻译速率下降 3Ag+HNO3+3HCl===3AgCl↓+NO↑+2H2O 1.5≤pH<5 取最后一次洗涤液少量于试管中,滴入稀硝酸,再加入硝酸银溶液,若没有白色沉淀生成,证明洗涤干净,反之,沉淀没有洗涤干净 Cu2++2e-===Cu 将CuCl2溶液在HCl气流中加热蒸干
Cu2++2H2O 低于50℃,溶解反应较慢,超过50℃,H2O2分解与HCl逸出导致溶解翻译速率下降 3Ag+HNO3+3HCl===3AgCl↓+NO↑+2H2O 1.5≤pH<5 取最后一次洗涤液少量于试管中,滴入稀硝酸,再加入硝酸银溶液,若没有白色沉淀生成,证明洗涤干净,反之,沉淀没有洗涤干净 Cu2++2e-===Cu 将CuCl2溶液在HCl气流中加热蒸干
【解析】
结合题干信息,根据工艺流程图分析可知,某废银合金触电材料含Ag、Cu、Sn等,在加热、溶解的条件下通入H2O2和HCl溶液,Cu和Sn变成Cu2+和Sn4+,再通入尿素在加热的条件下得到CuCl2溶液和Sn(OH)4沉淀,最终经过系列操作得到铜粉和SnO2,Ag单质以滤渣的形式经过HNO3和HCl溶液的溶解得到AgCl的沉淀,再加入Zn和H2SO4溶液进行化学反应得到Ag单质,据此分析解答问题。
(1)根据上述分析,“加热溶解”时,Cu与HCl、H2O2反应变为Cu2+,离子反应方程式为Cu+2H++H2O2![]() Cu2++2H2O,故答案为:Cu+2H++H2O2
Cu2++2H2O,故答案为:Cu+2H++H2O2![]() Cu2++2H2O;
Cu2++2H2O;
(2)温度过低,反应速率慢,温度过高,反应物H2O2分解,则温度不宜过高也不宜过低的原因是低于50℃,溶解反应较慢,超过50℃,H2O2分解与HCl逸出导致溶解翻译速率下降,故答案为:低于50℃,溶解反应较慢,超过50℃,H2O2分解与HCl逸出导致溶解翻译速率下降;
(3)根据上述分析可知,“滤渣”主要成分为Ag,“酸溶解”过程为Ag和HNO3、HCl反应得到AgCl的沉淀,化学反应方程式为:3Ag+HNO3+3HCl===3AgCl↓+NO↑+2H2O,故答案为:3Ag+HNO3+3HCl===3AgCl↓+NO↑+2H2O;
(4)调节pH为保证Sn4+沉淀完全(离子浓度小于10-5mol·L-1),按c(Sn4+)=1×10-5 mol·L-1进行计算,根据Ksp[Sn(OH)4]=1×10-55可得,c(OH-)=1×10-12.5 mol·L-1,则c(H+)=1×10-1.5 mol·L-1,pH=1.5,为保证Cu2+(0.022 mol·L-1)不沉淀,按c(Cu2+)=0.022 mol·L-1进行计算,根据Ksp[Cu(OH)2]=2.2×10-20可得,c(OH-)=1×10-9 mol·L-1,则c(H+)=1×10-5 mol·L-1,pH=5,则pH的取值范围1.5≤pH<5,故答案为:1.5≤pH<5;
(5)沉淀中可能附着的有Cl-,检验是否洗净的方法可以是取最后一次洗涤液少量于试管中,滴入稀硝酸,再加入硝酸银溶液,若没有白色沉淀生成,证明洗涤干净,反之,沉淀没有洗涤干净,故答案为:取最后一次洗涤液少量于试管中,滴入稀硝酸,再加入硝酸银溶液,若没有白色沉淀生成,证明洗涤干净,反之,沉淀没有洗涤干净;
(6)惰性电极电解CuCl2溶液时,阴极Cu2+得到电子,电极反应为Cu2++2e-===Cu,由于CuCl2会水解,可在蒸发时通入HCl气体抑制水解,故答案为:Cu2++2e-===Cu;将CuCl2溶液在HCl气流中加热蒸干。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某溶液中由水电离出的c(H+)=1×10-11mol/L,该溶液不可能是( )
A. 硫酸氢钠溶液 B. 醋酸钠溶液 C. 氢氧化钠溶液 D. 二氧化硫水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
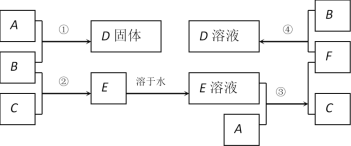
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应。又知E溶液是无色的。
请回答:
(1)写出A、B、C的化学式。A:___________________ B:___________________ C:____________________
(2)反应①的化学方程式为:________________________________________________
(3)反应③的化学方程式为:________________________________________________
(4)反应④的离子方程式为:________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pc类似pH,是指稀溶液中离子的物质的量浓度的负对数。如溶液中某离子的物质的量浓度为![]() ,则该溶液中离子的pc=2。下列叙述正确的是( )
,则该溶液中离子的pc=2。下列叙述正确的是( )
A.用0.01mol·L-1的盐酸滴定某浓度的NaOH溶液,溶液的pH逐渐增大
B.向0.01mol·L-1的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pc(Ca2+)逐渐减小
C.0.01mol·L-1的Na2CO3溶液中,pc(Na+)=2pc(CO![]() )
)
D.常温下,纯水中pc(H+)+pc(OHˉ)=14
查看答案和解析>>
科目:高中化学 来源: 题型:
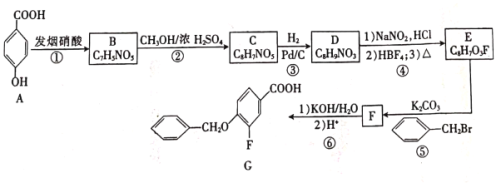
【题目】我国研究人员发现茶叶中的EGCG能有效阻断新冠病毒S蛋白与人体ACE2受体的结合。制备EGCG的中间体G的一种合成路线如下:
已知: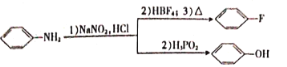
回答下列问题:
(1)G中官能团的名称是______。
(2)反应①的反应类型是____________。
(3)F与KOH溶液反应的化学方程式为__________________。
(4)芳香族化合物X与D互为同分异构体,其中属于硝酸酯(![]() )的X有______种,且核磁共振氢谱有3组峰,峰面积之比为6∶2∶1的结构简式为______(只写一种)。
)的X有______种,且核磁共振氢谱有3组峰,峰面积之比为6∶2∶1的结构简式为______(只写一种)。
(5)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。下列关于EGCG(结构简式如图)的说法错误的是______(填标号)。

A.含有两种官能团
B.分子中含有两个手性碳原子
C.能与![]() 溶液发生显色反应
溶液发生显色反应
D.1 mol EGCG与NaOH溶液反应,最多消耗8 mol NaOH
(6)1,4—苯并二恶烷(![]() )是制备原发性高血压药物多沙唑嗪的中间体,设计以苯酚和1,2—二溴乙烷为原料制备1,4—苯并二恶烷的合成路线(无机试剂任用)____________________。
)是制备原发性高血压药物多沙唑嗪的中间体,设计以苯酚和1,2—二溴乙烷为原料制备1,4—苯并二恶烷的合成路线(无机试剂任用)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G的结构简式为 ,下列关于有机物G的说法错误的是
,下列关于有机物G的说法错误的是
A.分子式为C10H12O5
B.1 mol G与足量的金属钠反应,生成H2的体积为33.6 L
C.在一定条件下,1 mol G与足量的H2反应,最多消耗3 mol H2
D.可发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇俗称酒精,75%的酒精能用来杀菌消毒。下列说法中正确的是( )
A.乙醇的球棍模型: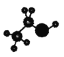
B.酒精的杀菌消毒原理是让蛋白质变性,且浓度越大消毒效果越好
C.酒精可以通过大量喷洒来消毒,也可以和84消毒液混合使用消毒
D.95%的酒精和蒸馏水以体积比75:20混合可配制75%的酒精(忽略体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产、国防等方面有广泛应用。
(1)基态铁原子的价电子排布式为________。
(2)Fe2+易被氧化成Fe3+,从微粒结构上分析其主要原因是________。
(3)原子坐标参数可表示晶胞内部各原子的相对位置。金属铁是体心立方晶系,其构型如图。其中原子坐标参数A(0,0,0)、B(1,0,0),则C原子的坐标参数为________。
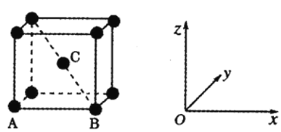
若晶胞参数为apm,假定金属铁原子为等径的刚性小球且处于体对角线上的三个球相切,则铁原子的半径为________pm。
(4)FeO是离子晶体,其晶格能可通过下图的循环得到,则FeO的晶格能为________。
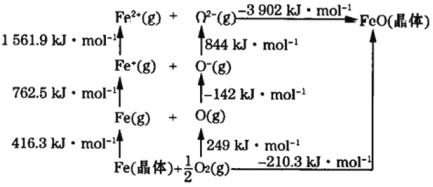
(5)下图是![]() 晶体的晶胞示意图。
晶体的晶胞示意图。
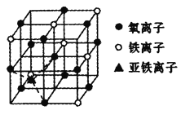
①晶胞中亚铁离子处于氧离子围成的_____空隙中(填空间结构)。
②若晶胞的体对角线长为anm,则Fe3O4晶体的密度为___![]() (阿伏加德罗常数用NA表示)
(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(ZnS)=1.6×10-24;pM=-lgc(M2+)(M2+为Cu2+或Zn2+)。常温下,向10mL0.10mol·L-1CuCl2溶液中滴加0.10mol·L-1Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是
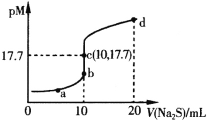
A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向上移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com