
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol/L硫酸溶液、NaOH溶液。下列说法错误的是
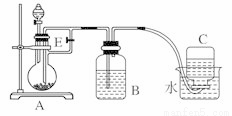
A. B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B. 实验开始时应先将活塞E关闭
C. 生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中
D. 取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高二下学期期初化学试卷 题型:选择题
根据同分异构体的概念,判断下列物质互为同分异构体的是( )
A. CH3﹣CH2﹣NO2 和 H2N﹣CH2﹣COOH
B. H和D
C. 甲烷和正丁烷
D. 红磷和白磷
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:选择题
某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是
A. ①和②中发生的反应均为复分解反应
B. 向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C. 一段时间后②中有胶冻状物质生成
D. 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:选择题
东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”是指( )
A. 金 B. 硫 C. 铜 D. 铁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100 mL的两份溶液进行如下实验。
①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是
A. 由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L
B. 原溶液肯定没有Fe3+、Mg2+,一定含有Na+
C. n(NH4+):n(Al3+):n(SO42-)=3:1:10
D. 原溶液一定存在Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A. 向明矾溶液中加入氢氧化钡溶液至沉淀的物质的量达到最大值:Al3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ AlO2-+2H2O
B. 向澄清石灰水中通入少量CO2:OH- + CO2=HCO3-
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2CH3COOH=Ca2++ 2CH3COO-+H2O + CO2↑
D. 硝酸银溶液中加入铜粉:Ag+ + Cu=Cu2+ + Ag
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关叙述正确的是
A. 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B. 同体积、同密度的C2H4和CO,两种气体的分子数一定相等
C. 配制450 mL 0.1 mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g
D. 1 L 0.45 mol·L-1NaCl溶液中Cl-的物质的量浓度比0.1L 0.15 mol·L-1AlCl3溶液大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
含n克HNO3的稀溶液恰好与m克Fe完全反应,若HNO3只被还原为NO,则n:m可能
①5:1、②9:2、③3:1、④2:1、⑤4:1( )
A. ②③⑤ B. ①③④ C. ②③④ D. ①③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_____________ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________ (选填“酸性”“中性”或“碱性”),理由是__________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为_____________________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应 ≥____________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com