
 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:分析 (1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据化学反应速率v=$\frac{△c}{△t}$进行计算;
(3)Z的转化率=$\frac{Z的物质的量变化}{Z的初始物质的量}$×100%;
(4)从曲线的变化特点分析.
解答 解:(1)由图象可以看出,反应中Z、Y的物质的量减少,应为反应物,X的物质的量增多,应为生成物,
当反应进行到3min时,△n(Y)=0.8mol-0.6mol=0.2mol,△n(Z)=1.6mol-1.2mol=0.4mol,△n(X)=0.6mol,
则△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,则该反应的化学方程式为:Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至2min末,X的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
(3)根据图象可知,平衡时Z的物质的量变化为:△n(Z)=1.6mol-1.2mol=0.4mol,则Z的转化率为:$\frac{0.4mol}{1.6mol}$×100%=25%,
故答案为:25%;
(4)3min后,各物质的物质的量不再发生变化,说明该反应已经达到反应限度,
故答案为:在此条件下该反应已达到反应限度(或化学平衡).
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡的特征为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 由非电解质溶于水得到的溶液 | |
| B. | [H+]、[OH-]均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
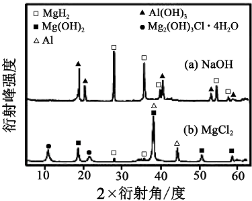
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

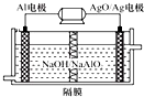
| A. | 该电池放电时,正极的电极反应为O2+4H++4e-═2H2O | |
| B. | 该电池充电时,阴极发生了氧化反应:Li++e-═Li | |
| C. | 电池中的有机电解液可以用稀盐酸代替 | |
| D. | 正极区产生的LiOH可回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
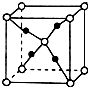 X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)
X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶于水只发生扩散作用 | |
| B. | 氢氧化钠溶于水只发生水合作用 | |
| C. | 氢氧化钠溶于水扩散过程吸收热量大于水合过程放出的热量 | |
| D. | 氢氧化钠溶于水扩散过程吸收热量小于水合过程放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
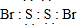 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com