
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的________吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是
(注明试剂、现象)。
(3)由泡铜(主要成分为Cu2O、Cu)冶炼粗铜的化学反应方程式
为__________ _______。
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
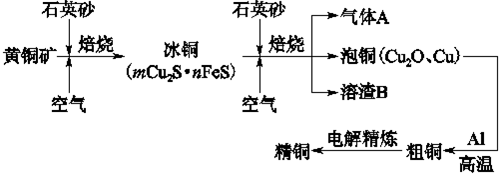
查看答案和解析>>
科目:高中化学 来源:2013届天津市天津一中高三第二次月考化学试卷(带解析) 题型:填空题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: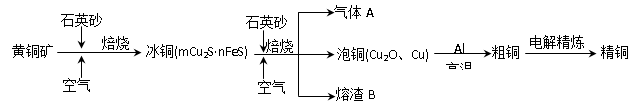
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的方法是_____________________________(注明试剂、现象)。若检验溶液中还存在Fe2+的方法是__________(注明试剂、现象),写出反应的离子方程式:____________________________
己知:Ksp [Fe(OH)3]= 4.0×10-38, 若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH为5,此时Fe3+的浓度
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.CuSO4溶液的浓度不变 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
精炼后电解质溶液中的阳离子有:_____________________________________
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市高三第二次月考化学试卷(解析版) 题型:填空题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的方法是_____________________________(注明试剂、现象)。若检验溶液中还存在Fe2+的方法是__________(注明试剂、现象),写出反应的离子方程式:____________________________
己知:Ksp [Fe(OH)3]= 4.0×10-38, 若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH为5,此时Fe3+的浓度
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.CuSO4溶液的浓度不变 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
精炼后电解质溶液中的阳离子有:_____________________________________
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com