
| A. | 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 | |
| B. | 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 | |
| C. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| D. | 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |
分析 A.标准液浓度偏小,造成V(标准)偏大;
B.用待测液润洗锥形瓶,则待测液的物质的量增大;
C.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大;
D.使用pH试纸测定溶液酸碱性时,试纸湿润相当于将溶液稀释了.
解答 解:A.酸式滴定管用蒸馏水洗后未用标准液润洗就装标准液滴定,标准液浓度偏小,造成V(标准)偏大,可知c(待测)偏大,故A错误;
B.用待测液润洗锥形瓶,则待测液的物质的量增大,造成V(标准)偏大,可知c(待测)偏大,故B错误;
C.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,所测温度值偏小,故C错误;
D.pH试纸湿润后,若测定中性溶液,不影响结果,所以用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH,故D正确.
故选D.
点评 本题考查较为综合,涉及基础实验操作和中和滴定等知识,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
 四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 molA+2 molB | |
| B. | 4 mol C+1 molD+2mol A+1 mol B | |
| C. | 1.6mol C+0.3 molD+1.2mol A+0.6 mol B | |
| D. | 4 mol C+0.8molD |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
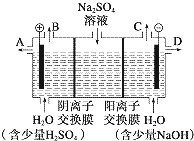 某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能和溴水迅速反应 | B. | 苯酚具有极弱酸性 | ||
| C. | 室温时苯酚不易溶解于水 | D. | 液态苯酚能与钠反应放出氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com