
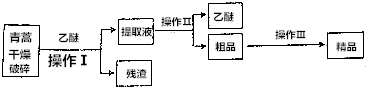
 四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:分析 (1)由仪器a的结构可知为球形冷凝管,采取逆流原理通入冷凝水,充满整个冷凝管,充分冷凝;
(2)四碘化锡遇水易水解,装有无水CaCl2的干燥管可吸收空气中的水蒸气;锡箔需剪碎增大与I2的接触面;醋酸酐能与水反应;
(3)锡与碘反应生成四碘化锡,单质碘过量可使锡反应完全;
(4)碘蒸气为紫红色,反应结束时紫色消失;
(5)醋酸易溶于氯仿,除掉杂质,提纯SnI4产品,根据Sn计算生成SnI4的理论质量,产率=$\frac{实际质量}{理论产率}$×100%.
解答 解:(1)仪器a的名称为球形冷凝管,冷凝水下进上出,使冷凝水充满整个冷凝管,充分冷凝,
故答案为:球形冷凝管;b;
(2)四碘化锡遇水易水解,装有无水CaCl2的干燥管可吸收空气中的水蒸气,防止空气中水蒸气进入反应器中,导致四碘化锡水解,锡箔需剪碎增大与I2的接触面,加快反应速率;醋酸酐能与水反应,防止四碘化锡水解,
故答案为:防止空气中水蒸气进入反应器中;增大与I2的接触面,加快反应速率;除去体系中的水,防止四碘化锡水解;
(3)锡与碘反应生成四碘化锡,Sn+2I2$\frac{\underline{\;\;△\;\;}}{\;}$SnI4,单质碘过量可使锡反应完全,防止锡屑混入四碘化锡晶体中,
故答案为:Sn+2I2$\frac{\underline{\;\;△\;\;}}{\;}$SnI4;使锡反应完全,防止锡屑混入四碘化锡晶体中;
(4)紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色,说明反应到达终点,
故答案为:紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色;
(5)醋酸易溶于氯仿,除掉杂质,提纯SnI4产品,
生成SnI4的理论质量为$\frac{0.476g}{119g/mol}$×(119+127×4)=2.508g,则产率=$\frac{1.881g}{2.508g}$×100%=75%,
故答案为:提纯SnI4产品;75%.
点评 本题考查物质的制备实验,涉及物质的分离提纯、化学仪器识别、对操作与原理的分析评价、产率计算等,注意对题目信息运用,是对学生综合能力的考查.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
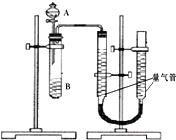 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/ml | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 | |
| B. | 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 | |
| C. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| D. | 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com