
(1)起始时正反应速率是平衡时反应速率的倍数。
(2)在
(3)在温度不变时再向平衡体系中加入2 mol SO2、2 mol O2和4 mol SO3平衡将向哪个方向移动。
解析:(1)起始时c(SO2)=![]() =2 mol·L-1,c(O2)=
=2 mol·L-1,c(O2)=![]() =1 mol·L-1,v(正)=K1·c2(SO2)·c(O2)=K1·(2 mol·L-1)2×(1 mol·L-1)=4K1 mol3·L-3,平衡时c(SO2)=2 mol·L-1×50%=1 mol·L-1,c(SO3)=1 mol·L-1,c(O2)=1 mol·L-1-1 mol·L-1×
=1 mol·L-1,v(正)=K1·c2(SO2)·c(O2)=K1·(2 mol·L-1)2×(1 mol·L-1)=4K1 mol3·L-3,平衡时c(SO2)=2 mol·L-1×50%=1 mol·L-1,c(SO3)=1 mol·L-1,c(O2)=1 mol·L-1-1 mol·L-1×![]() =0.5 mol·L-1
=0.5 mol·L-1
v′(正)=K1×(1 mol·L-1)2×0.5 mol·L-1=0.5K1 mol3·L-3
v(正)/v′(正)=![]() =8
=8
(2)K2=![]() =
=
(3)加入物质后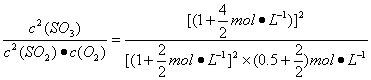
=1.5 mol·L-1。
因为1.5 mol·L-1<
答案:(1)8
(2)
(3)正反应方向。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:物理教研室 题型:022
2I-+2Fe3+ƒ2Fe2++I2(aq)
(1)该反应的平衡常数K的表达式为:K=________,当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”或“不”)。
(2)上述反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)×cn(Fe3+)(k为常数)
浓度与反应速率的关系
c(I-)/mol×L-1 c(Fe3+)/mol×L-1 v/
mol×L-1
(1) 0.20 0.80 0.032k
(2) 0.60 0.40 0.144k
(3) 0.80 0.20 0.128k
通过所给的数据计算可知:
在v=kcm(I-)×cn(Fe3+)中,m、n的值为( )
A.m=1,n=1 B.m=1,n=2
C.m=2,n=1 D.m=2,n=2
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
k2[c(C)]c[c(D)]d,其中 ![]() 、
、![]() 为速率常数。达平衡时 k=
为速率常数。达平衡时 k=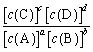 ,且
,且![]() 、
、![]() 、k只与温度有关。现将4mol
SO2和2mol O2充入容积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%。则:
、k只与温度有关。现将4mol
SO2和2mol O2充入容积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%。则:
(1)起始时正反应速率是平衡时的________倍。
(2)在500℃时该反应的平衡常数k是________。
(3)在温度不变时再向平衡体系中加入2mol SO2、2mol O2和4mol SO3,平衡将向________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:022
对于反应aA+bBƒcC+dD,反应达到平衡时,K=c(C)c×c(D)d/c(A)a×c(B)b(K为平衡常数),Fe3+和I-在水溶液中的反应如下:
2I-+2Fe3+ƒ2Fe2++I2(aq)
(1)该反应的平衡常数K的表达式为:K=________,当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”或“不”)。
(2)上述反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)×cn(Fe3+)(k为常数)
浓度与反应速率的关系
c(I-)/mol×L-1 c(Fe3+)/mol×L-1 v/ mol×L-1×s-1
(1) 0.20 0.80 0.032k
(2) 0.60 0.40 0.144k
(3) 0.80 0.20 0.128k
通过所给的数据计算可知:
在v=kcm(I-)×cn(Fe3+)中,m、n的值为( )
A.m=1,n=1 B.m=1,n=2
C.m=2,n=1 D.m=2,n=2
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:022
对于反应aA+bBƒcC+dD反应达平衡时,瞬时速率v正=k1[c(A)]a[c(B)]b,v逆=
k2[c(C)]c[c(D)]d,其中 ![]() 、
、![]() 为速率常数。达平衡时 k=
为速率常数。达平衡时 k=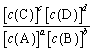 ,且
,且![]() 、
、![]() 、k只与温度有关。现将4mol
SO2和2mol O2充入容积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%。则:
、k只与温度有关。现将4mol
SO2和2mol O2充入容积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%。则:
(1)起始时正反应速率是平衡时的________倍。
(2)在500℃时该反应的平衡常数k是________。
(3)在温度不变时再向平衡体系中加入2mol SO2、2mol O2和4mol SO3,平衡将向________移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com