
【题目】下面列出了几组物质,请将物质的合适序号填写在空格上。同位素__;同一个物质__;同分异构体__;同素异形体__。
①金刚石与石墨;②D与T;③12C和13C;④O2与O3;⑤CH4和CH3-CH2-CH3;⑥CH2=CHCH3和CH2=CH2;⑦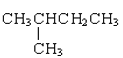 和CH3-CH2-CH2-CH2-CH3;⑧
和CH3-CH2-CH2-CH2-CH3;⑧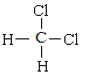 和
和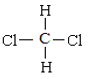
【答案】②③ ⑧ ⑦ ①④
【解析】
①金刚石和石墨均为C元素的单质,是同素异形体;
②D和T,质子数均为1,中子数分别为1和2,互为同位素;
③12C和13C质子数相同,中子数不同,互为同位素;
④O2和O3均为O元素构成的单质,是同素异形体;
⑤CH4和CH3CH2CH3,结构相似,分子相差2个CH2,是同系物;
⑥CH3CH=CH2和CH2=CH2,都是单烯烃,结构相似,分子相差1个CH2,是同系物;
⑦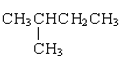 和CH3-CH2-CH2-CH2-CH3分子式均为C5H12,结构式不同,是同分异构体;
和CH3-CH2-CH2-CH2-CH3分子式均为C5H12,结构式不同,是同分异构体;
⑧甲烷是空间四面体结构,其二氯代物只有一种结构,因此这两种物质是同一种物质;
则同位素是②③;同一个物质是⑧;同分异构体是⑦;同素异形体是①④。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
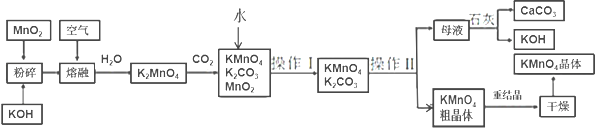
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列________________物质相似。
a.75%酒精 b.双氧水 c.苯酚 d.“84”消毒液(NaClO溶液)
(2)粉碎的目的是________________,操作Ⅰ的名称是________________
(3)上述流程中可以循环使用的物质有石灰、CO2、_________和__________(写化学式)。
(4)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是____________。
(5)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:
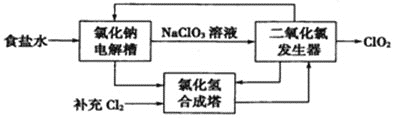
①写出氯化钠电解槽内发生反应的离子方程式:________________________。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目:_____________。
(2)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:
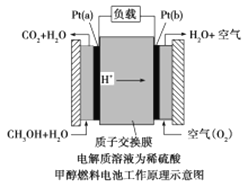
请回答下列问题:
Pt(a)电极是电池的_______极,电极反应式为______________________;
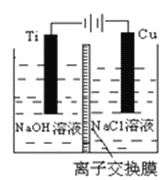
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
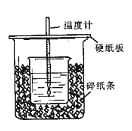
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业利用菱镁矿(主要含MgCO3,还含有Al2O3、FeCO3杂质)制取氯化镁的工艺流程。
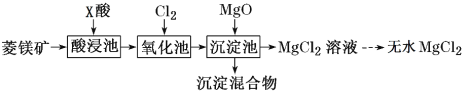
下列说法不正确的是( )
A.酸浸池中加入的X酸是硝酸
B.氧化池中通入氯气的目的是将Fe2+氧化为Fe3+
C.沉淀混合物为Fe(OH)3和Al(OH)3
D.在工业上常利用电解熔融氯化镁的方法制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
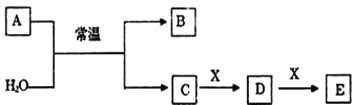
①若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___________________。
②若A为淡黄色粉末,X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为_________(填代号)。
a.盐酸 b.BaCl2溶液 c.Ca(OH)2溶液
③若A为非金属氧化物,B为气体,遇空气会变红棕色,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式________________。
(2)含碘化合物在生产、生活中都有重要用途,如碘化钠在医疗及食品方面有重要的作用,实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。水合肼(具有还原性)的制备有关反应原理为: CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。B、D中装分别装的试剂是____________
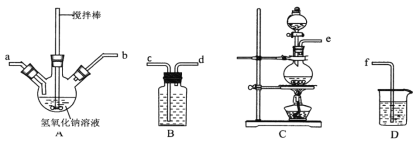
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5∶1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
查看答案和解析>>
科目:高中化学 来源: 题型:
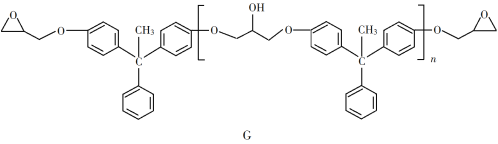
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
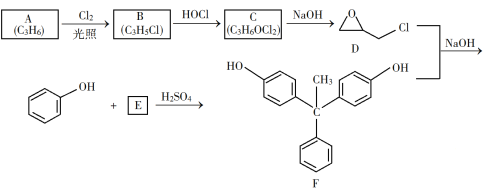
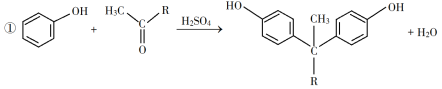
已知以下信息:
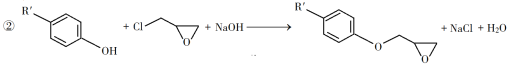
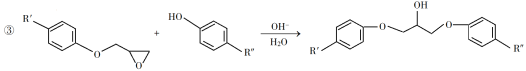
(1)A是一种烯烃,化学名称为__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式_____、_______。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765 g,则G的n值理论上应等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置(夹持和尾气处理装置已省略)进行的相应实验,能达到实验目的的是( )
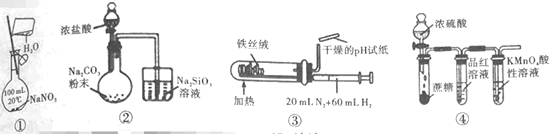
A.利用①装置,配制一定物质的量浓度的NaNO3溶液
B.利用②装置,验证元素的非金属性:Cl>C>Si
C.利用③装置,合成氨并检验氨的生成
D.利用④装置,验证浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),2min末反应达到平衡状态,此时测得D、C的浓度均为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,此时测得D、C的浓度均为0.4mol/L,请填写下列空白:
(1)x值等于_____________。
(2)A的转化率为_______________。
(3)生成D的反应速率为_____________。
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 _________(增大、减小或不变)。
(5)在此温度下,该化学反应的平衡常数k=__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com