
��λ����һ������Ĺ��ۼ��������õ��Ӷ���ijԭ�ӵ������ṩ����һ�ṩ�չ�������ӽ�ϡ���NH������NH3(��ԭ���ṩ���Ӷ�)��H��(�ṩ�չ��)ͨ����λ���γɵġ��ݴˣ��ش��������⣺
��1�����������п��ܴ�����λ������
A��CO2 B��H3O�� C��CH4 D��[Ag(NH3)2] +
��2��������ͭ��Һ�еμӰ�ˮ��������ɫ���������������μӣ������ܽ⣬��Һ�������ɫ����д�������ܽ�����ӷ���ʽ ��
��3����λ��ѧ��ʼ��ά���ɷ��֣�����Ϊ1mol��CoCl3��6NH3(��ɫ)��CoCl3��5NH3(�Ϻ�ɫ)��CoCl3��4NH3(��ɫ)��CoCl3��4NH3(��ɫ)�������������ˮ������������������Һ�������Ȼ��������ֱ�Ϊ3mol��2mol��1mol����1mol����֪����������������ӵ���λ����Ϊ6�������ʵ����ʵ����������ʽд�����ǵĻ�ѧʽ��
��CoCl3��5NH3 ��CoCl3��4NH3����ɫ��
��1��B D Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- Cu(OH)2+4NH3��H2O=[Cu(NH3)4]2++2OH-+4 H2O
��3���� [Co(NH3)5Cl]Cl2 ��: [Co(NH3)4Cl2]Cl
��������
�����������1��A��CO2���м��Թ��ۼ�������B��H3O�����м��Թ��ۼ�����λ������ȷ�� C��CH4���м��Թ��ۼ�������D��[Ag(NH3)2] +���м��Թ��ۼ�����λ������ȷ����2��������ͭ��Һ�еμӰ�ˮ�����ȷ���������Ӧ��Cu2++2NH3��H2O= Cu(OH)2��+2NH4+��������ɫCu(OH)2����������ˮ����ʱ������Ϸ�Ӧ��Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-���������ܽ⣬��ɺ����İ���ͭ���ӵ�����ɫ��Һ����3�����������֪������������ӵ���λ����Ϊ6���������е�Cl-������Ag+��ϡ����Ԣ�CoCl3��5NH3�Ļ�ѧʽΪ[Co(NH3)5Cl]Cl2����CoCl3��4NH3�Ļ�ѧʽΪ: [Co(NH3)4Cl2]Cl��
���㣺�������ӷ���ʽ����д�����������ӵ����ʼ���ѧʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и�����һ��ģ�⿼�Ի�ѧ�Ծ��������棩�� ���ͣ�ѡ����
������Һ�е�Cl�����ʵ�����100ml 1 mol��L��1AlCl3��Һ��Cl����ȵ��ǣ� ��
A��150ml 1 mol��L��1NaCl��Һ B��100ml 3mol��L��1KClO3��Һ
C�� 75ml 2 mol��L��1MgCl2��Һ D��50ml 1 mol��L��1FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ijϩ����H2�ӳɺ�IJ�����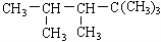 , ���ϩ���Ľṹʽ������( )
, ���ϩ���Ľṹʽ������( )
A��1�� B��2�� C��3�� D��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ����㿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH(g)��H2O(g)��CO2(g)��3H2(g) ?��H ����49.0 kJ/mol
��CH3OH(g)��1/2O2(g)��CO2(g)��2H2(g) ?��H����192.9 kJ/mol
����������Ӧ������˵����ȷ����
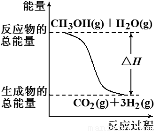
A����Ӧ���е������仯����ͼ��ʾ
B������֪2H2(g)��O2(g)��2H2O(g) ?��H����483.8 kJ/mol
C��1 mol CH3OH���ȼ�շų�������Ϊ192.9 kJ
D��CH3OHת���H2�Ĺ���һ��Ҫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ����㿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A��ʯ���ѽ����֬���������ɸ߷�������С���ӵĹ���
B����ϩ����������ԭ�Ӳ�������ͬһƽ����
C����CH3��3CCH2CH3��һ�ȴ�����3��
D���ױ�������������������ˮ����ɿ���ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��������У�߶���ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
���и������Ļ���ֻҪ������һ���������������ϣ���ȫȼ�պ����ɵ�CO2��H2O���Ǻ�������( )
A��C2H2��C2H4 B��C2H4��C4H6 C��C2H6��C3H6 D��C6H6��C2H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��������У�߶���ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
��Է�������Ϊ100�������Һ���4������ͬ���칹�干��(�����������칹)�� ��
A��3�� B��4�� C��5�� D��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�¸��������в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
M�DZ���ͬϵ���ṹΪ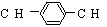 ����M�Ľṹʽ����
����M�Ľṹʽ����
A �� 16 �� B �� 12 �� C �� 10 �� D �� 8 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡТ������У�����߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й��������ʵıȽ�˳���У�����ȷ���� �� ��
A�����뾶��K+��Na+��Mg2+��Al3+
B�����ȶ��ԣ�HF��HCl��HBr��HI
C�����ԣ�HClO4��H2SO4��H3PO4��H2SiO3
D���۵㣺Li��Na��K��Rb
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com