
已知反应Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是(_____)

A.电极X是正极,其电极反应为Cu-2e-=Cu2+
B.银电极质量逐渐减小,Y溶液中c(Ag+)增大
C.实验过程中取出盐桥,原电池仍继续工作
D.当X电极质量减少0.64g时,外电路中有0.02mol电子转移
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:选择题
N2+3H2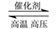 2NH3是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
2NH3是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
A. 增加N2的浓度能加快反应速率 B. 降低体系温度能加快反应速率
C. 使用催化剂不影响反应速率 D. N2足量时,H2能100%转化为NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:计算题
下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全。已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有 效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。
效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。
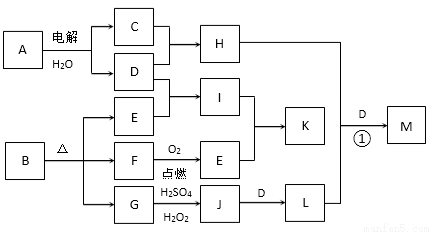
根据以上信息,回答下列问题:
⑴H的化学式为____________________________。
⑵ A的电子式___________________________________________。
⑶ G→J的离子方程式为________________________________________________________________。
⑷ M是含氧酸盐,化学式为Na2FeO4,则反应①的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:选择题
一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2+3H2 2NH3(正反应是放热反应).下列有关说法正确的是
2NH3(正反应是放热反应).下列有关说法正确的是
A. 升高温度能加快反应速率
B. 1mol N2和3mol H2的总能量低于2mol NH3的总能量
C. 达到化学反应限度时,生成2molNH3
D. 平衡时各组分含量之比一定等于3:1:2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:选择题
“保护环境”是我国的基本国策。下列做法不应该提倡的是
A. 采取低碳、节俭的生活方式 B. 按照规定对生活废弃物进行分类放置
C. 深入农村和社区宣传环保知识 D. 绿色化学的核心是应用化学原理治理环境污染
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
对于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是( )
A. 该酸式盐的水溶液一定显酸性
B. 在该盐溶液中,离子浓度为c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 若HY-能水解,水解方程式为HY-+H2O Y2-+H3O+
Y2-+H3O+
D. 若HY-能电离,电离方程式为HY-+H2O Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
对于可逆反应3H2+N2 2NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A. 增大压强 B. 充入更多N2 C. 使用高效催化剂 D. 降低温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省洛阳市高二(平行班)3月月考化学试卷(解析版) 题型:选择题
在核磁共振氢谱中出现两组峰,其峰面积之比为3:2的化合物是( )
A.  B.
B. 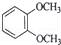 C.
C. 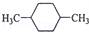 D.
D. 
查看答案和解析>>
科目:高中化学 来源:2017届江苏省苏州市高三上学期期末考试化学试卷(解析版) 题型:简答题
化学工业中会产生大带含铬废水,需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72- 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
① 写出NaHSO3与Cr2O72-反应的离子方程式:__________________________________。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31。若除去废水中Cr3+,使其浓度小于1×10-5 mol•L-1,此时溶液中的c(H+)<_________mol•L-1
(2)废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应后生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+  Cr2O72-
Cr2O72-  I2
I2 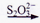 S4O62-
S4O62-
① 上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会________(选填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 mol•L-1的Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示),写出计算过程。_____________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com