
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2017届安徽省“江南十校”高三3月联考理综化学试卷(解析版) 题型:简答题
Zn(OH)2可溶于氨水生成[Zn(NH3)4]2+: Zn(OH)2+4NH3·H2O=Zn(NH3)4]2++4H2O+2OH-
(1)原子序数比Zn元素小1的元素符号为____,该元素原子基态核外电子排布式为______。
(2)NH3、H2O的沸点均高于同族元素氢化物的沸点,是因为________。
(3)NH3中N原子轨道的杂化类型是______。
(4)与H2O分子互为等电子体的分子为_____。
(5)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如右图所示),则在立方ZnS晶体结构中S2-的配位数为________。Zn2+的分数坐标为(l/4,l/4,l/4)、(3/4, 3/4,l/4)、(3/4,l/4,3/4)、(1/4,3/4,3/4),则S2-的分数坐标为______。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
已知反应Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是(_____)

A.电极X是正极,其电极反应为Cu-2e-=Cu2+
B.银电极质量逐渐减小,Y溶液中c(Ag+)增大
C.实验过程中取出盐桥,原电池仍继续工作
D.当X电极质量减少0.64g时,外电路中有0.02mol电子转移
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是
A. 少量Na2SO4固体,v(H2)减小 B. VmLBaCl2溶液,v(H2)不变
C. 加入细小的碳粒,v(H2)增大 D. 加入NH4HSO4固体,v(H2)不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
反应 A+B→C(△H<0)分两步进行:①A+B→X (△H>0),②X→C(△H<0).下列示意图中,能正确表示总反应过程中能量变化的是( )
A. 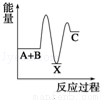 B.
B. 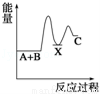 C.
C.  D.
D. 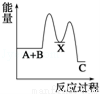
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省洛阳市高二(平行班)3月月考化学试卷(解析版) 题型:选择题
下列描述中正确的是
A. ClO3-的空间构型为平面三角形
B. SiF4和 SO32-的中心原子均为 sp3杂化
C. 在所有的元素中,氟的第一电离能最大
D. C2H5OH 分子中共含有 8 个极性键,1 个 π 键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省洛阳市高二(平行班)3月月考化学试卷(解析版) 题型:选择题
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和. 下列说法正确的是( )
A. 原子半径C>D>E,三者形成的简单离子中D离子的半径最小
B. 元素A所形成的氢化物常温下一定为气态
C. 元素C、D、E在自然界中均不能以游离态存在
D. 元素B的氧化物对应的水化物一定为强酸
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三第四次月考化学试卷(解析版) 题型:实验题
(17分)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。
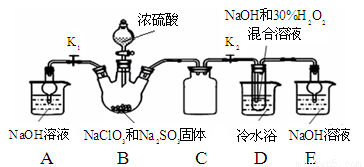
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶;
ii.趁热过滤;
iii. ;
iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二下学期学业水平测试(二)化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温常压下,80 g SO3含有的原子数目为NA
B. 常温常压下,22.4 L甲醛(HCHO)含有的原子数目为4NA
C. 铝热反应中,每1 molAl参加反应,失去的电子数目为3NA
D. 1.0L 0.5mol/LKClO3溶液中含有的氯离子数目为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com