
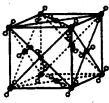
 短周期元素E、F的离子F+与E2-核外电子排布相同,B、D、E元素的原子序数依次递增,B原子的每个能级上电子数相等,BE2和D2E是等电子体、A是F所在周期非金属性最强的元素,G.E同主族且原子核外电子层数相差两层,
短周期元素E、F的离子F+与E2-核外电子排布相同,B、D、E元素的原子序数依次递增,B原子的每个能级上电子数相等,BE2和D2E是等电子体、A是F所在周期非金属性最强的元素,G.E同主族且原子核外电子层数相差两层,| 7+1-2×3 |
| 2 |
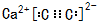 ;Se处于第四周期ⅥA族,其原子基态价层电子排布式为4s24p4,
;Se处于第四周期ⅥA族,其原子基态价层电子排布式为4s24p4,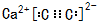 ;4s24p4;
;4s24p4;| 1 |
| 8 |
| 1 |
| 2 |
| 44 |
| NA |
| 3 |
| ||||
| 3 |
| ||
| 3 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)表中所列元素中:
属于短周期元素的有_______;
属于主族元素的有_______;
e元素在元素周期表中的位置是_______周期,_______族。
(2)下列_______组元素的单质可能都是电的良导体。
A. a,c,h
B. b,g,k
C. c,h,l
D. d,e,f
(3)将元素a,c,d,f,l,b的原子半径按从小到大的顺序排列:_______。
(4)i元素属于_______(填“金属”或“非金属”)元素,它的最离化合价是_______,最低化合价是_______。它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用作干燥剂,写出它与氧气反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省东阳市高三下学期期中考试化学试卷 题型:填空题
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图 ;
F元素氧化物的晶体类型为 。
(2)比较B、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式: ,该阳离
子中存在的化学键有 ,并写出该阳离子与F氢化物的水溶
液反应的离子方程式: 。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:2011届四川省成都市石室中学高三“三诊”模拟考试(理综)化学部分 题型:单选题
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离予相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。下列说法正确( )
A.B的最高价氧化物对应水化物化学性质稳定
B.C、D、E、F原子半径由大到小的顺序为C>D>E>F
C.B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
D.元素D、E、F的单质晶体属于同种类型的晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com