
在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| C.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
C
解析试题分析:A、平衡常数数据分析,平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,故A错误;B、恒温恒压下,向容器中再充入少量的Ar,压强增大保持恒压,平衡向气体体积增大的方向进行,上述平衡将逆向移动,故C错误;C、80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol?L-1,Qc=c(Ni(CO)4)/c4(CO)=0.5/0.54=8>2,说明平衡逆向进行,则此时v(正)<v(逆),故C正确;D、恒温恒容下,向容器中再充入少量的Ni(CO)4(g),相当于增大压强平衡正向进行,达到新平衡时,CO的百分含量将减小,故D错误。
考点:化学平衡的影响因素


科目:高中化学 来源: 题型:单选题
反应Fe(s)+CO2(g) FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是( )
| A.升高温度该反应的正反应速率增大,逆反应速率减小 |
B.该反应的化学平衡常数表达式为K= |
| C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 |
| D.该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A(g)+B(g)  2C(g) ΔH<0,达到平衡时,下列说法正确的是
2C(g) ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡不移动
B.加入催化剂,B的转化率增大
C.增大c(A),A的转化率增大
D.降低温度,v正 增大,v逆 减小
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,向密闭容器中加入X物质发生反应:3X(g)  Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
| 反应时间(min) | 0 | 5 | 15 | 17 | 20 |
| X的浓度(mol·L-1) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)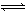 Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
| A.在容器中加入氩气,反应速率不变 |
| B.加入少量W,逆反应速率增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下反应2AB(g) A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内三种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )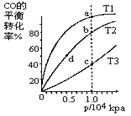
| A.平衡常数:K(a)>K(c) K(b)=K(d) |
| B.正反应速率:v(a)>v(c) v(b)>v(d) |
| C.平均摩尔质量:M(a)<M(c) M(b)>M(d) |
| D.平衡时a点一定有n(CO):n(H2)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在反应2A + B 3C +4D中,表示该反应速率最快的是
A.ν(A)=0.5mol/(L·s) B.ν(B)=0.3mol/(L·s)
C.ν(C)=0.8mol/(L·s) D.ν(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
改变下列条件,能使N2(g)+3H2(g) 2NH3(g) △H<0平衡向逆反应方向移动的是
2NH3(g) △H<0平衡向逆反应方向移动的是
| A.升高温度 | B.增大压强 | C.增大H2的浓度 | D.使用催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com