
ЎҫМвДҝЎҝНӯКЗЦШТӘҪрКфЈ¬CuөД»ҜәПОпФЪҝЖС§СРҫҝәН№ӨТөЙъІъЦРҫЯУРРн¶аУГНҫЈ¬Из![]() ИЬТәіЈУГЧчөзҪвТәЎўөз¶ЖТәөИЈ®Зл»ШҙрТФПВОКМвЈә
ИЬТәіЈУГЧчөзҪвТәЎўөз¶ЖТәөИЈ®Зл»ШҙрТФПВОКМвЈә
![]() СЗНӯАлЧУ
СЗНӯАлЧУ![]() »щМ¬КұөДәЛНвөзЧУЕЕІјКҪОӘ ______
»щМ¬КұөДәЛНвөзЧУЕЕІјКҪОӘ ______
![]() ҫ§МеөД¶С»э·ҪКҪКЗ ______ Ј¬ЖдЕдО»КэОӘ ______ Ј»
ҫ§МеөД¶С»э·ҪКҪКЗ ______ Ј¬ЖдЕдО»КэОӘ ______ Ј»
![]() НщБтЛбНӯИЬТәЦРјУИл№эБҝ°ұЛ®Ј¬ҝЙЙъіЙ
НщБтЛбНӯИЬТәЦРјУИл№эБҝ°ұЛ®Ј¬ҝЙЙъіЙ![]() Ј¬ПВБРЛө·ЁХэИ·өДКЗ ______
Ј¬ПВБРЛө·ЁХэИ·өДКЗ ______
A.![]() ЦРЛщә¬өД»ҜС§јьУРАлЧУјьЎўј«РФјьәНЕдО»јь
ЦРЛщә¬өД»ҜС§јьУРАлЧУјьЎўј«РФјьәНЕдО»јь
B.ФЪ![]() ЦР
ЦР![]() ёшіц№ВөзЧУ¶ФЈ¬
ёшіц№ВөзЧУ¶ФЈ¬![]() МṩҝХ№мөА
МṩҝХ№мөА
C.![]() ЧйіЙФӘЛШЦРөЪТ»өзАлДЬЧоҙуөДКЗСхФӘЛШ
ЧйіЙФӘЛШЦРөЪТ»өзАлДЬЧоҙуөДКЗСхФӘЛШ
D.![]() Ул
Ул![]() »ҘОӘөИөзЧУМеЈ¬ҝХјд№№РНҫщОӘХэЛДГжМе
»ҘОӘөИөзЧУМеЈ¬ҝХјд№№РНҫщОӘХэЛДГжМе
![]() °ұ»щТТЛбНӯөД·ЦЧУҪб№№ИзНјЈ¬МјФӯЧУөДФУ»Ҝ·ҪКҪОӘ______ЎЈёГ·ЦЧУЦР
°ұ»щТТЛбНӯөД·ЦЧУҪб№№ИзНјЈ¬МјФӯЧУөДФУ»Ҝ·ҪКҪОӘ______ЎЈёГ·ЦЧУЦР![]() јьУл
јьУл![]() јьёцКэұИЦөОӘ ______
јьёцКэұИЦөОӘ ______
![]() ФЪ№иЛбСОЦРЈ¬
ФЪ№иЛбСОЦРЈ¬![]() ЛДГжМе
ЛДГжМе![]() ИзНј
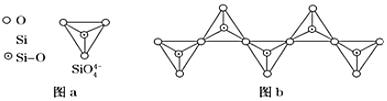
ИзНј![]() НЁ№э№ІУГ¶ҘҪЗСхАлЧУҝЙРОіЙөәЧҙЎўБҙЧҙЎўІгЧҙЎў№ЗјЬНшЧҙЛДҙуАаҪб№№РНКҪЎЈНјbОӘТ»ЦЦОЮПЮіӨөҘБҙҪб№№өД¶а№иЛбёщЈ¬SiУлOөДФӯЧУКэЦ®ұИОӘ ______ Ј¬»ҜС§КҪОӘ ______ ЎЈ
НЁ№э№ІУГ¶ҘҪЗСхАлЧУҝЙРОіЙөәЧҙЎўБҙЧҙЎўІгЧҙЎў№ЗјЬНшЧҙЛДҙуАаҪб№№РНКҪЎЈНјbОӘТ»ЦЦОЮПЮіӨөҘБҙҪб№№өД¶а№иЛбёщЈ¬SiУлOөДФӯЧУКэЦ®ұИОӘ ______ Ј¬»ҜС§КҪОӘ ______ ЎЈ
Ўҫҙр°ёЎҝ![]() »т
»т![]() ГжРДБў·ҪЧоГЬ¶С»э
ГжРДБў·ҪЧоГЬ¶С»э![]() »т
»т![]() 12 AD
12 AD ![]() Ўў
Ўў![]() 9Јә1 1Јә3
9Јә1 1Јә3 ![]() »т
»т![]()
ЎҫҪвОцЎҝ
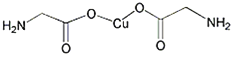
(1)ЎўCuФӯЧУК§ИҘ4sДЬј¶1ёцөзЧУРОіЙСЗНӯАлЧУЈ»
(2)ЎўCuҫ§МеөД¶С»э·ҪКҪКЗГжРДБў·ҪЧоГЬ¶С»эЈ¬ЕдО»КэОӘ12Ј»
(3)ЎўНщБтЛбНӯИЬТәЦРјУИл№эБҝ°ұЛ®Ј¬ҝЙЙъіЙ[Cu (NH3) 4]SO4, ОӘЕдәПОпЈ¬ЖдЦРCu2+МṩҝХ№мөАЈ¬NH3Мṩ№ВөзЧУ¶ФЈ»
(4)ЎўёщҫЭМјФӯЧУөДіЙјьЗйҝцТӘТФЕР¶ПМјФӯЧУөДФУ»Ҝ·ҪКҪЈ»·ЦЧУЦРә¬УР2ёцҰРјьЈ¬ЖдЛьОӘҰТјьЈ»
(5)Ўў![]() ЦРјЫІгөзЧУ¶ФёцКэКЗ4ЗТІ»ә¬№ВөзЧУ¶ФЈ¬АыУГҫщМҜ·ЁјЖЛгЖдФӯЧУёцКэұИЈ¬ҙУ¶шИ·¶ЁЖд»ҜС§КҪЎЈ
ЦРјЫІгөзЧУ¶ФёцКэКЗ4ЗТІ»ә¬№ВөзЧУ¶ФЈ¬АыУГҫщМҜ·ЁјЖЛгЖдФӯЧУёцКэұИЈ¬ҙУ¶шИ·¶ЁЖд»ҜС§КҪЎЈ
![]() ФӯЧУК§ИҘ4sДЬј¶1ёцөзЧУРОіЙСЗНӯАлЧУЈ¬»щМ¬КұСЗНӯАлЧУәЛНвөзЧУЕЕІјКҪОӘОӘЈә
ФӯЧУК§ИҘ4sДЬј¶1ёцөзЧУРОіЙСЗНӯАлЧУЈ¬»щМ¬КұСЗНӯАлЧУәЛНвөзЧУЕЕІјКҪОӘОӘЈә![]() »т
»т![]() Ј¬
Ј¬
№Кҙр°ёОӘЈә![]() »т
»т![]() Ј»
Ј»
![]() ҫ§МеөД¶С»э·ҪКҪКЗГжРДБў·ҪЧоГЬ¶С»эЈ¬ФЪҪрКфҫ§МеөДЧоГЬ¶С»эЦРЈ¬¶ФУЪГҝёцФӯЧУАҙЛөЈ¬ФЪЖдЦЬО§өДФӯЧУУРУлЦ®Н¬Т»ІгЙПУРБщёцФӯЧУәНЙПТ»ІгөДИэёцј°ПВТ»ІгөДИэёцЈ¬№КГҝёцФӯЧУЦЬО§¶јУР12ёцФӯЧУУлЦ®ПаБ¬Ј¬
ҫ§МеөД¶С»э·ҪКҪКЗГжРДБў·ҪЧоГЬ¶С»эЈ¬ФЪҪрКфҫ§МеөДЧоГЬ¶С»эЦРЈ¬¶ФУЪГҝёцФӯЧУАҙЛөЈ¬ФЪЖдЦЬО§өДФӯЧУУРУлЦ®Н¬Т»ІгЙПУРБщёцФӯЧУәНЙПТ»ІгөДИэёцј°ПВТ»ІгөДИэёцЈ¬№КГҝёцФӯЧУЦЬО§¶јУР12ёцФӯЧУУлЦ®ПаБ¬Ј¬
№Кҙр°ёОӘЈәГжРДБў·ҪЧоГЬ¶С»э![]() »т
»т![]() Ј»12Ј»
Ј»12Ј»
![]() ОӘАлЧУ»ҜәПОпЈ¬ә¬УРАлЧУјьЈ¬ҙжФЪ
ОӘАлЧУ»ҜәПОпЈ¬ә¬УРАлЧУјьЈ¬ҙжФЪ![]() ј«РФјьТФј°
ј«РФјьТФј°![]() ЕдО»јьЈ¬№КAХэИ·Ј»
ЕдО»јьЈ¬№КAХэИ·Ј»
B.ФЪ![]() ЦР
ЦР![]() МṩҝХ№мөАЈ¬
МṩҝХ№мөАЈ¬![]() Мṩ№ВөзЧУ¶ФЈ¬№КBҙнОуЈ»
Мṩ№ВөзЧУ¶ФЈ¬№КBҙнОуЈ»
C.![]() ЧйіЙФӘЛШЦРөЪТ»өзАлДЬЧоҙуөДКЗNФӘЛШЈ¬ЧоНвІгОӘ°лідВъЧҙМ¬Ј¬№КCҙнОуЈ»
ЧйіЙФӘЛШЦРөЪТ»өзАлДЬЧоҙуөДКЗNФӘЛШЈ¬ЧоНвІгОӘ°лідВъЧҙМ¬Ј¬№КCҙнОуЈ»
D.![]() Ул
Ул![]() »ҘОӘөИөзЧУМеЈ¬Ҫб№№ПаЛЖЈ¬ЦРРДФӯЧУРОіЙ4ёц
»ҘОӘөИөзЧУМеЈ¬Ҫб№№ПаЛЖЈ¬ЦРРДФӯЧУРОіЙ4ёц![]() јьЈ¬ҝХјд№№РНҫщОӘХэЛДГжМеЈ¬№КDХэИ·Ј®
јьЈ¬ҝХјд№№РНҫщОӘХэЛДГжМеЈ¬№КDХэИ·Ј®
№Кҙр°ёОӘЈәADЈ»
![]() °ұ»щТТЛбНӯөД·ЦЧУЦРҙжФЪ
°ұ»щТТЛбНӯөД·ЦЧУЦРҙжФЪ![]() јьЈ¬МјөДФУ»Ҝ·ҪКҪОӘ
јьЈ¬МјөДФУ»Ҝ·ҪКҪОӘ![]() ФУ»ҜЈ¬ә¬УРұҘәНМјФӯЧУЈ¬МјөДФУ»Ҝ·ҪКҪОӘ
ФУ»ҜЈ¬ә¬УРұҘәНМјФӯЧУЈ¬МјөДФУ»Ҝ·ҪКҪОӘ![]() ФУ»ҜЈ»·ЦЧУЦРә¬УР4ёц
ФУ»ҜЈ»·ЦЧУЦРә¬УР4ёц![]() јьЎў4ёц
јьЎў4ёц![]() јьЈ¬2ёц
јьЈ¬2ёц![]() јьЎў2ёц
јьЎў2ёц![]() јьЎў2ёц
јьЎў2ёц![]() јьЈ¬2ёц
јьЈ¬2ёц![]() јьЈ¬ТФј°2ёц
јьЈ¬ТФј°2ёц![]() јьЈ¬Фт№Іә¬УР18ёц
јьЈ¬Фт№Іә¬УР18ёц![]() јьЈ¬2ёц
јьЈ¬2ёц![]() јьЈ¬ёГ·ЦЧУЦР
јьЈ¬ёГ·ЦЧУЦР![]() јьУл
јьУл![]() јьёцКэұИЦөОӘ9Јә1Ј¬
јьёцКэұИЦөОӘ9Јә1Ј¬
№Кҙр°ёОӘЈә![]() Ўў
Ўў![]() Ј»9Јә1Ј»
Ј»9Јә1Ј»
![]() ёщҫЭНјЖ¬ЦӘЈ¬ГҝёцИэҪЗЧ¶Ҫб№№ЦРSiФӯЧУКЗ1ёцЈ¬OФӯЧУёцКэ
ёщҫЭНјЖ¬ЦӘЈ¬ГҝёцИэҪЗЧ¶Ҫб№№ЦРSiФӯЧУКЗ1ёцЈ¬OФӯЧУёцКэ![]() Ј¬ЛщТФ№иФӯЧУәНСхФӯЧУёцКэЦ®ұИ
Ј¬ЛщТФ№иФӯЧУәНСхФӯЧУёцКэЦ®ұИ![]() Јә3Ј¬3ёцOФӯЧУҙш6ёцөҘО»ёәөзәЙЈ¬Гҝёц№иФӯЧУҙш4ёцөҘО»ХэөзәЙЈ¬ЛщТФРОіЙАлЧУОӘ
Јә3Ј¬3ёцOФӯЧУҙш6ёцөҘО»ёәөзәЙЈ¬Гҝёц№иФӯЧУҙш4ёцөҘО»ХэөзәЙЈ¬ЛщТФРОіЙАлЧУОӘ![]()
![]() »т
»т![]() Ј¬№Кҙр°ёОӘЈә1Јә3Ј»
Ј¬№Кҙр°ёОӘЈә1Јә3Ј»![]() »т
»т![]()


 ФД¶БҝміөПөБРҙр°ё
ФД¶БҝміөПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіОВ¶ИКұЈ¬Ag2SO4ФЪЛ®ИЬТәЦРөДіБөнИЬҪвЖҪәвЗъПЯИзНјЛщКҫЈ¬ПВБРЛө·ЁЦРІ»ХэИ·өДКЗ(ЎЎЎЎ)
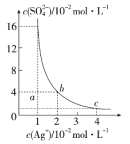
A.bөг¶ФУҰөДKspөИУЪcөг¶ФУҰөДKsp
B.ІЙИЎХф·ўИЬјБөД·Ҫ·ЁҝЙТФК№ИЬТәҙУaөгұдөҪbөг
C.ёГОВ¶ИПВЈ¬Ag2SO4өДИЬ¶И»эіЈКэ(Ksp)ОӘ1.6ЎБ10-5(molL-1)3
D.0.02molL-1өДAgNO3ИЬТәУлөД0.2molL-1өДNa2SO4ИЬТәөИМе»э»мәПІ»»бЙъіЙіБөн
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪДі100mL»мәПТәЦРЈ¬HNO3әНH2SO4өДОпЦКөДБҝЕЁ¶И·ЦұрКЗ0.4mol/LәН0.1mol/LЎЈПтёГ»мәПТәЦРјУИл1.92gНӯ·ЫЈ¬јУИИЈ¬ҙэід·Ц·ҙУҰәуЈ¬ЛщөГИЬТәЦРөДCu2+өДОпЦКөДБҝЕЁ¶ИКЗ( )mol/L
A. 0.15 B. 0.225 C. 0.35 D. 0.45
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘПВБРИИ»ҜС§·ҪіМКҪ,»ШҙрПВБРОКМвЈә
ўЩ2H2ЈЁgЈ©+O2ЈЁgЈ©=2H2OЈЁlЈ© ҰӨH=©Ғ570kJ![]()
ўЪ2H2OЈЁgЈ©=2H2ЈЁgЈ©+O2ЈЁgЈ© ҰӨH=+483.6kJ![]()
ўЫ2CЈЁsЈ©+O2ЈЁgЈ©=2COЈЁgЈ© ҰӨH=©Ғ220.8kJ![]()
ўЬCЈЁsЈ©+O2ЈЁgЈ©=CO2ЈЁgЈ© ҰӨH=©Ғ393.5kJ![]()
ЈЁ1Ј©ЙПКц·ҙУҰЦРКфУЪ·ЕИИ·ҙУҰөДКЗ_____ЈЁМоРҙРтәЕЈ©Ј»
ЈЁ2Ј©H2өДИјЙХИИОӘ_____Ј»
ЈЁ3Ј©ИјЙХ8g H2ЙъіЙТәМ¬Л®Ј¬·ЕіцөДИИБҝОӘ_____Ј»
ЈЁ4Ј©H2OЈЁlЈ©=H2OЈЁgЈ©ҰӨH=______Ј»
ЈЁ5Ј©COөДИјЙХИИөДИИ»ҜС§·ҪіМКҪОӘ__ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіОВ¶ИПВЈ¬Ме»эҫщОӘ2LөДәгИЭГЬұХИЭЖчўсәНўтЈ¬ПтўсЦРјУИл1molCOәН2mol![]() Ј¬ПтўтЦРјУИл2molCOәН4mol
Ј¬ПтўтЦРјУИл2molCOәН4mol![]() Ј¬ҫщ·ўЙъПВБР·ҙУҰІўҪЁБўЖҪәвЈә
Ј¬ҫщ·ўЙъПВБР·ҙУҰІўҪЁБўЖҪәвЈә![]()
![]() ЎЈІвөГІ»Н¬ОВ¶ИПВCOЖҪәвЧӘ»ҜВКИзНјЛщКҫЈ¬ПВБРЛө·ЁХэИ·өДКЗ
ЎЈІвөГІ»Н¬ОВ¶ИПВCOЖҪәвЧӘ»ҜВКИзНјЛщКҫЈ¬ПВБРЛө·ЁХэИ·өДКЗ![]()
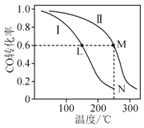
A.ёщҫЭМвёЙЦРРЕПўЈ¬ҝЙНЖ¶ПёГ·ҙУҰөД![]()
B.·ҙУҰЦРLЎўMБҪөгИЭЖчДЪС№ЗҝЈә![]()
C.ҝЙТФјЖЛгіцёГ·ҙУҰҙҰУЪNөгКұЈ¬»ҜС§ЖҪәвіЈКэФјОӘ![]()
D.ПтNөгЖҪәвМеПөЦРФЩјУИл1mol![]() Ј¬РВЖҪәвКұЗвЖшөДФцјУБҝРЎУЪ
Ј¬РВЖҪәвКұЗвЖшөДФцјУБҝРЎУЪ![]() mol
mol
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТФ·јПгМюAОӘФӯБПәПіЙУР»ъОпFәНIөДәПіЙВ·ПЯИзПВЈә

ЈЁ1Ј©AөД·ЦЧУКҪОӘ__________Ј¬CЦРөД№ЩДЬНЕГыіЖОӘ________________ЎЈ
ЈЁ2Ј©D·ЦЧУЦРЧо¶аУР______ёцФӯЧУ№ІЖҪГжЎЈ
ЈЁ3Ј©EЙъіЙFөД·ҙУҰАаРНОӘ___________Ј¬GөДҪб№№јтКҪОӘ__________ЎЈ
ЈЁ4Ј©УЙHЙъіЙIөД»ҜС§·ҪіМКҪОӘ______________ЎЈ
ЈЁ5Ј©·ыәППВБРМхјюөДBөДН¬·ЦТм№№МеУР_______ЦЦЈЁІ»ҝјВЗБўМеТм№№Ј©Ј¬ЖдЦРәЛҙЕ№ІХсЗвЖЧОӘ4Чй·еЈ¬ЗТГж»эұИОӘ6Јә2Јә1Јә1өДКЗ________ЈЁРҙіцЖдЦРТ»ЦЦөДҪб№№јтКҪЈ©ЎЈ
ўЩКфУЪ·јПг»ҜәПОпЈ» ўЪДЬ·ўЙъТшҫө·ҙУҰЎЈ
ЈЁ6Ј©ТСЦӘ![]() Ј¬ІОХХЙПКцәПіЙВ·ПЯЈ¬ТФұҪәНұыЛбОӘФӯБПЈЁОЮ»ъКФјБИОСЎЈ©Ј¬ЙијЖЦЖұё
Ј¬ІОХХЙПКцәПіЙВ·ПЯЈ¬ТФұҪәНұыЛбОӘФӯБПЈЁОЮ»ъКФјБИОСЎЈ©Ј¬ЙијЖЦЖұё![]() өДәПіЙВ·ПЯ________________ЎЈ
өДәПіЙВ·ПЯ________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДЬФҙОКМвИХТжіЙОӘЦЖФј№ъјКЙз»бҫӯјГ·ўХ№өДЖҝҫұЈ¬ФҪАҙФҪ¶аөД№ъјТҝӘКјКөРРЎ°Сф№вјЖ»®ЎұЈ¬ҝӘ·ўМ«СфДЬЧКФҙЈ¬С°ЗуҫӯјГ·ўХ№өДРВ¶ҜБҰЎЈ
ўЕё»АХП©СЬЙъОпУЙУЪҫЯУРБјәГөД№вөзРФДЬЈ¬ФЪМ«СфДЬөзіШөДУҰУГЙПҫЯУР·ЗіЈ№вГчөДЗ°НҫЎЈё»АХП©ЈЁC60Ј©өДҪб№№ИзНјЛщКҫЈ¬·ЦЧУЦРМјФӯЧУ№мөАөДФУ»ҜАаРНОӘ___Ј»1 mol C60·ЦЧУЦРҰТјьөДКэДҝОӘ____ёцЎЈ
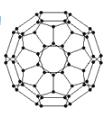
ўЖ¶аФӘ»ҜәПОпұЎДӨМ«СфДЬөзіШІДБПОӘОЮ»ъСОЈ¬ЖдЦчТӘ°ьАЁЙй»ҜпШЈЁGaAsЈ©ЎўБт»ҜпУЈЁCdSЈ©ұЎДӨөзіШөИЎЈ
өЪТ»өзАлДЬ:As____SeЈЁМоЎ°>ЎұЎ°<Ўұ»тЎ°=ЎұЈ©Ј¬АнУЙКЗ____________ЎЈ
ўЗИэ·ъ»ҜөӘЈЁNF3Ј©КЗТ»ЦЦОЮЙ«ЎўОЮО¶ЎўОЮ¶ҫЗТІ»ҝЙИјөДЖшМеЈ¬ФЪМ«СфДЬөзіШЦЖФмЦРөГөҪ№г·әУҰУГЎЈТСЦӘNF3УлNH3өДҝХјд№№РН¶јКЗИэҪЗЧ¶РОЈ¬NH3ТЧУлCu2+РОіЙЕдАлЧУЈ¬ө«NF3І»ТЧУлCu2+РОіЙЕдАлЧУЈ¬ЖдФӯТтКЗ___________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТ»¶ЁОВ¶ИПВЈ¬ФЪ3ёцИЭ»эҫщОӘ![]() өДәгИЭГЬұХИЭЖчЦР·ҙУҰ
өДәгИЭГЬұХИЭЖчЦР·ҙУҰ![]() ҙпөҪЖҪәвЈ¬ПВБРЛө·ЁХэИ·өДКЗ
ҙпөҪЖҪәвЈ¬ПВБРЛө·ЁХэИ·өДКЗ
ИЭЖч | ОВ¶И | ОпЦКөДЖрКјЕЁ¶И | ОпЦКөДЖҪәвЕЁ¶И | ||
|
|
|
| ||
ўс | 400 |
|
| 0 |
|
ўт | 400 |
|
| 0 |
|
ўу | 500 |
|
| 0 |
|
A. ёГ·ҙУҰөДХэ·ҙУҰКЗОьИИ·ҙУҰ
B. ҙпөҪЖҪәвКұЈ¬ИЭЖчўсЦР·ҙУҰОпЧӘ»ҜВКұИИЭЖчўтЦРөДРЎ
C. ҙпөҪЖҪәвКұЈ¬ИЭЖчўтЦР![]() РЎУЪИЭЖчўуЦР
РЎУЪИЭЖчўуЦР![]()
D. ҙпөҪЖҪәвКұЈ¬ИЭЖчўуЦРөДХэ·ҙУҰЛЩВКұИИЭЖчўсЦРөДРЎ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөИОпЦКөДБҝөДX(g)УлY(g)ФЪГЬұХИЭЖчЦРҪшРРҝЙДж·ҙУҰЈәX(g)Ј«Y(g) ![]() 2Z(g)Ј«W(s)ЎЎҰӨHЈј0Ј¬ПВБРРрКцХэИ·өДКЗЎЎЎЎЈЁЎЎЎЎЎЎЈ©
2Z(g)Ј«W(s)ЎЎҰӨHЈј0Ј¬ПВБРРрКцХэИ·өДКЗЎЎЎЎЈЁЎЎЎЎЎЎЈ©
A. ЖҪәвіЈКэKЦөФҪҙуЈ¬XөДЧӘ»ҜВКФҪҙу
B. ҙпөҪЖҪәвКұЈ¬·ҙУҰЛЩВКvХэ(X)ЈҪ2vДж(Z)
C. ҙпөҪЖҪәвәуҪөөНОВ¶ИЈ¬ХэПт·ҙУҰЛЩВКјхРЎөДұ¶КэҙуУЪДжПт·ҙУҰЛЩВКјхРЎөДұ¶Кэ
D. ҙпөҪЖҪәвәуЈ¬ЙэёЯОВ¶И»тФцҙуС№Зҝ¶јУРАыУЪёГ·ҙУҰЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶Ҝ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com