
分析 合成CH3COOCH2CH3流程图为:CH2=CH2$\stackrel{H_{2}O}{→}$CH3CH2OH$\stackrel{CH_{3}COOH}{→}$CH3COOCH2CH3,乙醇氧化生成乙酸,以此来解答.
解答 解:由CH2=CH2和H-OH为原料,制取CH3COOCH2CH3,需要经过加成、氧化、酯化反应来合成,
发生的反应为①CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,属于加成反应,
②2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,属于氧化反应,
③2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,属于氧化反应,
④CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,属于取代反应,
答:合成反应为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH、2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O、2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH、CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应类型分别为加成反应、氧化反应、氧化反应、取代反应.
点评 本题考查有机物的合成,为高频考点,把握有机物的官能团与性质、合成反应中官能团的变化为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.


科目:高中化学 来源: 题型:填空题
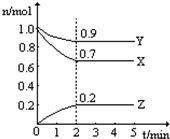 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是非金属元素 | B. | 最外层电子数相同 | ||
| C. | 原子半径相差不大 | D. | 最高化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、O | B. | Li、Be、Mg | C. | C、N、P | D. | O、C、F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2A+B→2C+Q | B. | 2C→2A+B+Q | C. | 2A(g)+B(g)→2C(g)+Q | D. | 2A(g)+B(g)→2C(g)-Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 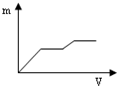 | C. | 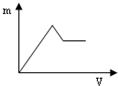 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁原子的价电子数比铝少 | |
| B. | 镁遇冷浓硝酸和硫酸,表面不能钝化,而铝均能 | |
| C. | 镁带能在空气中和在盛CO2的集气瓶里燃烧,而铝箔均不能 | |
| D. | 铝的硬度、延展性、熔点均比镁大、好、高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com