

分析 (1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀,正极发生还原反应,氧气得到电子被还原生成OH-;
(2)形成原电池,铜失电子作负极,铁离子在铜电极上得电子;总反应为负极和正极所在的电解质溶液的反应;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,甲烧杯中铁电极为阳极,阳极反应为Fe-2e-═Fe2+;
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,
③根据电极反应和串联电路各极上转移电子的数目相等进行计算.
解答 解:(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-,电极方程式为O2+4e-+2H2O-═4OH-,
故答案为:氧化;O2+4e-+2H2O-═4OH-;
(2)此装置为原电池,铜失电子作负极Cu-2e-═Cu2+,铁离子在铜电极上得电子2Fe3++2e-═2Fe2+,故石墨做正极;将正负极反应相加即得总反应:2Fe3++Cu═2Fe2++Cu2+,故答案为:正;2Fe3++Cu═2Fe2++Cu2+;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,
发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:正;Fe-2e-═Fe2+;
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为$\frac{0.64g}{64g/mol}$=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=$\frac{22.4L×0.02mol}{2mol}$=0.224L,即224ml,
故答案为:224.
点评 本题考查化学平衡常数、电化学知识,题目难度中等,做题时注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算.


科目:高中化学 来源: 题型:解答题
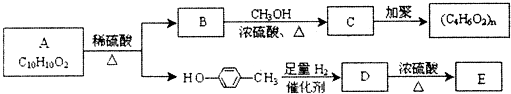
 、E
、E .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成份是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com