
(1)固体甲+溶液B![]() 溶液C+水
溶液C+水
(2)溶液A+溶液C![]() 固体甲+溶液D
固体甲+溶液D
(3)固体乙+溶液B![]() 溶液E+氢气
溶液E+氢气
根据以上关系,写出下列物质的化学式。
固体:甲_______________,乙________________,
溶液:A______________,B________________,C________________,?D________________,E________________,F________________。
写出所有发生反应的离子方程式:
(1)_______________________________________________________________。
(2)_______________________________________________________________。
(3)_______________________________________________________________。
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:阅读理解
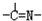 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若反应后铁有剩余,则容器中不可能有_______________,一定有______________。
(2)若反应后有Cu2+和Cu,则不可能有_________。
(3)若反应后有Cu2+和Fe3+,则可能有__________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省吉林市普通中学高一上学期期末考试化学试卷 题型:单选题
制印刷电路时常用FeCl3溶液作为“腐蚀液”,发生的反应为:
2 FeCl3 + Cu = 2FeCl2 + CuCl2
向盛有FeCl3溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
| A.有 Cu无Fe | B.有Fe无Cu |
| C.Fe、Cu都有 | D.Fe、Cu都无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种强电解质,它们在水中电离出的离子如右表所示,
阳离子 | Cu2+、K+、Fe2+、H+ |
阴离子 | SO42— 、OH- 、NO3- |
其中A、D、F电离产生的阳离子均为K+。另有甲、乙、丙三种固体,它们分别是铁粉、铜粉和Cu(OH)2固体中的某一种,它们与A、B、C、D、E在常温下有如下转化关系:
①固体乙+B溶液→E溶液+氢气
②固体甲+B溶液→C溶液+水
③A溶液+C溶液→固体甲+D溶液
请回答下列问题:
(1)写出下列物质的化学式:甲 ,乙 ,F 。
(2)写出下列反应的离子方程式:
反应① ;
反应③ 。
(3)用题目所涉及到的物质表示丙→C的化学方程式____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com