
碱金属单质的熔点顺序为Li>Na>K>Rb>Cs,试用金属晶体结构的知识加以解释.
金属晶体的熔点高低取决于晶体中金属离子与自由电子之间的作用力大小,由库仑定律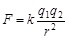 可知,作用力的大小又取决于金属离子的半径和自由电子的数量,显然,半径越小,作用力越强,熔点越高.而离子的半径顺序为
可知,作用力的大小又取决于金属离子的半径和自由电子的数量,显然,半径越小,作用力越强,熔点越高.而离子的半径顺序为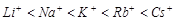 ,因此锂的熔点最高.
,因此锂的熔点最高.
【解析】试题分析:本题考查金属晶体熔沸点的比较方法。即金属键强弱的比较方法。金属键的实质是金属阳离子和自由电子的电性作用,故可以结合库伦定律加以分析,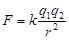 ,K为定值F大小取决于r和电量,r越小,电量越大,F越大,金属键越强烈,相应金属熔沸点越高。离子半径Li+<Na+<K+<Rb+<Cs+,故金属键自上而下逐渐减弱,熔沸点自上而下逐渐降低。
,K为定值F大小取决于r和电量,r越小,电量越大,F越大,金属键越强烈,相应金属熔沸点越高。离子半径Li+<Na+<K+<Rb+<Cs+,故金属键自上而下逐渐减弱,熔沸点自上而下逐渐降低。
考点:金属键强弱的比较
点评: 本题结合元素周律对金属强弱进行考查,相对形式较新颖,可以较好的考查学生能力。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:新教材新学案 配合普通高中课程标淮实验教科书 化学② 必修 题型:013
|
无机化学命名委员会(国际组织)在1989年作出决定,把长式周期表原先的主副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法正确的是 | |
| [ ] | |
A. |
第1列含有的元素最多 |
B. |
第2列中没有非金属元素 |
C. |
从上到下,第1列元素单质的熔点逐渐升高,而第17列元素单质的熔点逐渐降低 |
D. |
只有第2列元素的原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.第3列元素最少
B.第10列中没有非金属元素
C.从上到下,第1列元素单质的熔点逐渐升高,而第17列元素单质的熔点逐渐降低
D.只有第2列元素的原子最外层有2个电子
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com