
| A、铁有剩余 | B、往反应后溶液中滴入KSCN溶液不显红色 | C、Fe2+和Fe3+物质的量之比为6:1 | D、氧化产物与还原产物的物质的量之比为2:5 |


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)往500mL浓度为0.1mol·L-1的盐酸中加入一定量的铁粉,待铁粉全部反应后再通入适量氯气将Fe2+全部氧化,所得溶液与500mL浓度为0.02mol·L-1的某金属碘化物RIX的溶液混合,恰好能使I-全部转化为I2单质,这时,测得溶液的pH等于2,已知反应中R的化合价不变,并且设溶液混合时体积变化可忽略。求:
⑴加入铁粉的质量;
⑵RIX的x的值。
查看答案和解析>>
科目:高中化学 来源:安徽省模拟题 题型:填空题
查看答案和解析>>
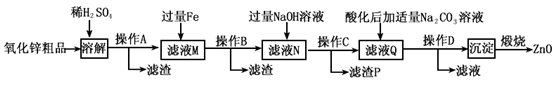
科目:高中化学 来源:2012-2013学年江苏省徐州市高三(上)期中化学试卷(解析版) 题型:解答题
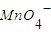 被还原成Mn2+.写出发生反应的离子方程式:______
被还原成Mn2+.写出发生反应的离子方程式:______查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com