
【题目】M是某香料的有效成分,其分子中含3个六元环。M的一种合成路线如图:

已知①A(C8H8)分子中所有原子可能共平面;②D的核磁共振氢谱上有6个峰;③H和I互为同系物。请回答下列问题:
(1)A的名称是___,E中所含官能团名称是___。
(2)B→C的反应类型是___。
(3)写出H和I反应生成M的化学方程式:___。
(4)T是H的同分异构体,同时具备下列条件的T有___种(不考虑立体异构),其中,苯环上一溴代物只有2种的结构简式为___。
①遇FeCl3溶液发生显色反应;②能发生水解反应和银镜反应。
(5)乳酸(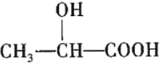 )在医药方面广泛用作防腐剂、载体剂、助溶剂等。参照上述流程,以2-丁烯和乙烯为原料合成乳酸,设计合成路线___(无机试剂任选)。
)在医药方面广泛用作防腐剂、载体剂、助溶剂等。参照上述流程,以2-丁烯和乙烯为原料合成乳酸,设计合成路线___(无机试剂任选)。
【答案】苯乙烯 羟基 取代反应 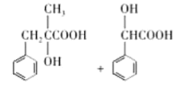
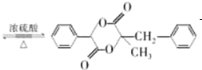 +2H2O 13
+2H2O 13 ![]() CH3CH=CHCH3
CH3CH=CHCH3![]() CH3CH=CH2
CH3CH=CH2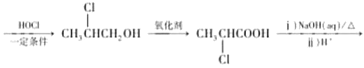
![]()
【解析】
A的分子式为C8H8,不饱和度=![]() =5,分子中可能含苯环,且分子中所有原子可能共平面,则A为:
=5,分子中可能含苯环,且分子中所有原子可能共平面,则A为:![]() ,C的分子式(C10H11Cl)+HCl刚好为D的分子式(C10H12Cl2),可知C到D为加成反应,又因为D的核磁共振氢谱上有6个峰,所以D为:
,C的分子式(C10H11Cl)+HCl刚好为D的分子式(C10H12Cl2),可知C到D为加成反应,又因为D的核磁共振氢谱上有6个峰,所以D为: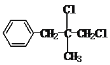 ,那么E为:
,那么E为: ,H和I是同系物且H能和I在浓硫酸和加热条件下反应生成M,结合E到I为氧化反应可知,I为:
,H和I是同系物且H能和I在浓硫酸和加热条件下反应生成M,结合E到I为氧化反应可知,I为: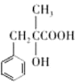 ,结合G的分子式可知H为:
,结合G的分子式可知H为: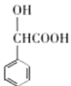 ,那么G为:
,那么G为:![]() ,F为:
,F为:![]() ,据此解答。
,据此解答。
(1)A的结构简式为:![]() ,名称:苯乙烯,E的结构简式为:
,名称:苯乙烯,E的结构简式为:![]() ,官能团为:羟基,故答案为:苯乙烯;羟基;
,官能团为:羟基,故答案为:苯乙烯;羟基;
(2)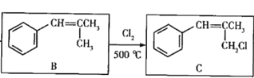 ,H原子被Cl取代,故答案为:取代反应;
,H原子被Cl取代,故答案为:取代反应;
(3)因为H和I反应生成M含三个六元环,所以H和I发生酯化成环反应,方程式为:
 +2H2O,故答案为:
+2H2O,故答案为:
 +2H2O;
+2H2O;
(4)H为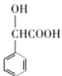 ,T为H的同分异构体:①遇FeCl3溶液发生显色反应,说明有酚羟基;②能发生水解反应和银镜反应,说明有HCOO-;侧链有2个的时候,侧链为酚羟基和HCOOCH2-,两个侧链分别处于邻间对共3种,侧链为3个的时候,侧链分别为:酚羟基、甲基、HCOO-,此时有10种,故共有3+10=13种。苯环上一溴代物只有2种的结构简式为:
,T为H的同分异构体:①遇FeCl3溶液发生显色反应,说明有酚羟基;②能发生水解反应和银镜反应,说明有HCOO-;侧链有2个的时候,侧链为酚羟基和HCOOCH2-,两个侧链分别处于邻间对共3种,侧链为3个的时候,侧链分别为:酚羟基、甲基、HCOO-,此时有10种,故共有3+10=13种。苯环上一溴代物只有2种的结构简式为:![]() ,故答案为:13;
,故答案为:13;![]() ;
;
(5)2一丁烯和乙烯为原料,乳酸(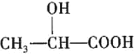 )为目标产物,一定要发生类似A到B的减碳反应,故先用2一丁烯和乙烯发生减碳反应生成
)为目标产物,一定要发生类似A到B的减碳反应,故先用2一丁烯和乙烯发生减碳反应生成![]() ,
,![]() 发生类似A到F到G到H的反应制得乳酸,流程为:CH3CH=CHCH3
发生类似A到F到G到H的反应制得乳酸,流程为:CH3CH=CHCH3![]() CH3CH=CH2
CH3CH=CH2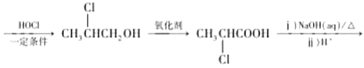
![]() ,故答案为:CH3CH=CHCH3
,故答案为:CH3CH=CHCH3![]() CH3CH=CH2
CH3CH=CH2
![]() 。
。


科目:高中化学 来源: 题型:
【题目】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。请回答下列问题:
(1)已知:①C2H6 (g)![]() C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
②H2 (g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol
③ C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
则表征 C2H6 (g)燃烧热的热化学方程式为_____。
(2)1000℃时,在某刚性容器内充入一定量的 C2H6 ,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙 烷的平衡转化率为 40%。
①乙烷分解前容器压强为_____Pa ,1000℃时,反应①的平衡常数 Kp=_____Pa[气体分压(P 分)=气体 总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_____40%(填“>”、“<” 或“=”)。
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
① 反应 C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
② 800℃时,控制原料气的总物质的量一定,当 C2H6 和 O2 的物质的量之比为 2:1 时,乙烯的平衡产率最大,而当![]() 较小时,乙烯的平衡产率较低,可能的原因为_____。
较小时,乙烯的平衡产率较低,可能的原因为_____。
(4)利用电解法可将 C2H6 转化为多种燃料,原理如图所示。铜电极为_____极,该电极上生成 HCOOH 的电极反 应式为_____。
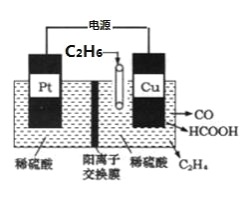
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组由Cu(NO3)2溶液先制得Cu(NO3)2·3H2O晶体,然后在下图所示实验装置中(夹持及控温装置省略),用Cu(NO3)2·3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知:SOCl2的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体。
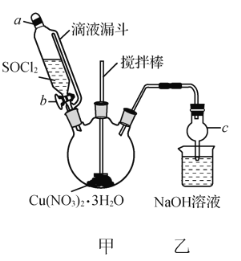
(1)由Cu(NO3)2溶液制得Cu(NO3)2·3H2O晶体的实验步骤包括蒸发浓缩、冷却结晶、抽滤等步骤。
①蒸发浓缩时当蒸发皿中出现______________________________(填现象)时,停止加热。
②为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是_______________(填一种)。
(2)①仪器c的名称是________。
②向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞________(填“a”或“b”或“a和b”)。
(3)装置甲中Cu(NO3)2·3H2O和SOCl2发生反应的化学方程式为__________________________________。
(4)装置乙的作用是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的3d轨道上有5个电子,试回答:
的3d轨道上有5个电子,试回答:
(1)M元素原子的核外电子排布式为________
(2)M元素原子的最外层电子数为______,价层电子数为______
(3)M元素在元素周期表中的位置为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N、P同属于元素周期表的第ⅤA族元素,N在第二周期,P在第三周期。![]() 分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是
分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是![]() 。
。
(1)![]() 分子的空间结构为
分子的空间结构为![]() ,它是一种_____(填“极性”或“非极性”)分子。
,它是一种_____(填“极性”或“非极性”)分子。
(2)![]() 分子与
分子与![]() 分子的构型关系_____(填“相同”“相似”或“不相似”),P—H键_____(填“有”或“无”)极性,
分子的构型关系_____(填“相同”“相似”或“不相似”),P—H键_____(填“有”或“无”)极性,![]() 分子_______(填“有”或“无”)极性。
分子_______(填“有”或“无”)极性。
(3)![]() 是一种淡黄色油状液体,下列对
是一种淡黄色油状液体,下列对![]() 的有关描述不正确的是___(填字母)。
的有关描述不正确的是___(填字母)。
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
d.因N—Cl键的键能大,故![]() 稳定
稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
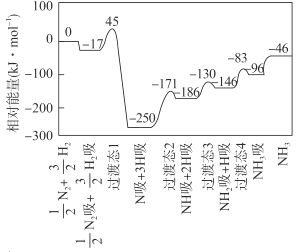
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下能大量共存的是( )
A.由水电离产生的c(H+)=1×10-10molL-1的溶液中:NO3-、Fe2+、Na+、SO42-
B.![]() =10-10molL-1的溶液中:NH4+、I-、Cl-、K+
=10-10molL-1的溶液中:NH4+、I-、Cl-、K+
C.![]() =1×106的溶液中:K+、Na+、Cl-、HCO3-
=1×106的溶液中:K+、Na+、Cl-、HCO3-
D.惰性电极电解AgNO3后的溶液中:SO32-、K+、Na+、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领域应用广泛,工业尾气中的SO2一直是环境污染的主要原因之一。
I.SO2尾气的处理
方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a.CaO(s)+CO(g) = CaCO3(s) ΔH= 178.3kJ·mol1
b.2CaCO3(s)+2SO2(g)+O2(g)= 2CaSO4(s)+2CO2(g) ΔH= 2762.2kJ·mol1
c.2CaSO3(s)+O2(g)= 2CaSO4(s) ΔH= 2314.8kJ·mol1
(1)写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:___。
方法2:用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4。
(2)实验测得NH4HSO3溶液中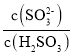 =1500,则溶液的pH为________(已知:H2SO3的Ka1=1.5×102,Ka2=1.0×107,K(NH3·H2O)=1.74×10-5;)。NH4HSO3溶液中所含粒子浓度大小关系正确的是_____。
=1500,则溶液的pH为________(已知:H2SO3的Ka1=1.5×102,Ka2=1.0×107,K(NH3·H2O)=1.74×10-5;)。NH4HSO3溶液中所含粒子浓度大小关系正确的是_____。
A c(NH4+)>c(HSO3-)>c(H+)>c(SO32)>c(OH-)
B c(HSO3-)>c(NH4+)>(SO32-)>c(H+)>c(OH-)
C c(NH4+)+c(NH3·H2O)=c(HSO3-)+2c(SO32)+c(H2SO3)
D c(H+)+c(H2SO3)=c(OH-)+c(SO32)+c(NH3·H2O)
II.SO2的回收利用:
(3)SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g)+Cl2(g)![]() SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:
SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:
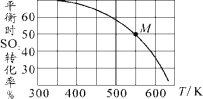
①恒温恒压条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是_______(填字母)。
a SO2Cl2的浓度保持不变 b 混合气体的压强不再改变
c 混合气体的密度不再改变 d 混合气体的平均相对分子质量不再改变
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=_____(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
III.(4)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为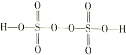 。在工业上用作强氧化剂。
。在工业上用作强氧化剂。
①在Ag+催化作用下,S2O82能与Mn2+在水溶液中发生反应生成SO42和MnO4,1molS2O82能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com