
已知甲和乙在溶液中的转化关系如图所示:

请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的结构示意图为 。
(2)若甲是10电子的阳离子,乙是碱性气体。1mol乙通入足量强酸溶液中与H+反应,反应过程中能量变化如下图:

写出乙的一种用途: ;
该反应的热化学方程式是___________________________。
(3)若甲是CrO42-(黄色)和Cr2O72-(橙色)的混合溶液,在该溶液中存在如下平衡:
CrO42-(黄色) + 2H+ Cr2O72-(橙色) + H2O
Cr2O72-(橙色) + H2O
若测得甲溶液的pH=1,该溶液显 色。
(4)若甲仅含有NO3-、SO42-和X三种离子,则X离子可能是 (填序号) 。
A.Fe2+ B.HCO3- C.Ba2+ D.Fe3+
(5)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=10,
则HCO3-的电离平衡常数Ka= 。
(10分)
(1)
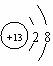 (2分)
(2分)
(2)制氮肥(或其它合理答案)(1分)
NH3(g) + H+(aq) ="=" NH4+(aq) △H=-(b-c)kJ· mol-1 (2分)
(3)橙(1分)
(4)D(2分)
(5)10-10(2分)
【解析】
试题分析:(1)根据所学知识分析,乙是Al(OH)3,则甲为Al3+,结构示意图为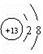 。
。
(2)与碱生成气体就是铵根,甲为NH4+,乙为NH3,乙的用途为可以用来制氮肥。根据图中信息分析,反应为吸热反应,反应的热化学方程式是NH3(g) + H+(aq) ="=" NH4+(aq) △H=-(b-c)kJ· mol-1。
(3)pH=1呈酸性,平衡正向移动,该溶液显橙色。
(4)根据溶液整体呈电中性及考虑离子共存,应为Fe3+,故选D。
(5)Ka=10-10*10-10/10-10=10-10。
考点:无机反应 热化学方程式的书写 平衡移动 离子共存 电离平衡常数
点评:本题考查的知识涉及无机反应、热化学方程式的书写、平衡移动、离子共存和电离平衡常数等知识,题目难度中,考查学生对分析问题、解决问题及计算的能力。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
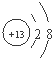
查看答案和解析>>
科目:高中化学 来源:2013届福建省三明一中、二中高三上学期期末联考化学试卷(带解析) 题型:填空题
已知甲和乙在溶液中的转化关系如图所示:
请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的结构示意图为 。
(2)若甲是10电子的阳离子,乙是碱性气体。1mol乙通入足量强酸溶液中与H+反应,反应过程中能量变化如下图:
写出乙的一种用途: ;
该反应的热化学方程式是___________________________。
(3)若甲是CrO42-(黄色)和Cr2O72-(橙色)的混合溶液,在该溶液中存在如下平衡:
CrO42-(黄色) + 2H+ Cr2O72-(橙色) + H2O
Cr2O72-(橙色) + H2O
若测得甲溶液的pH=1,该溶液显 色。
(4)若甲仅含有NO3-、SO42-和X三种离子,则X离子可能是 (填序号) 。
| A.Fe2+ | B.HCO3- | C.Ba2+ | D.Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com