
【题目】如图是电解水制高纯氢的示意图,通过控制开关连接K1或K2,可交替得到H2和O2。下列说法正确的是
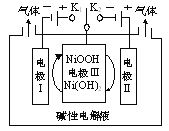
A.制H2时,连接K2
B.连接K1时,电极Ⅰ附近碱性减弱
C.制O2时,电极Ⅲ的反应为:NiOOH+e+H2O=Ni(OH)2+OH-
D.通过控制开关连接K1和K2,可使电极Ⅲ循环使用
【答案】CD
【解析】
该装置为电解池,通过控制开关连接K1或K2电解水,可交替得到H2和O2,在电解池中,阳极发生失电子的氧化反应,阴极发生得电子的还原反应。当开关闭合到K2时,所形成的电解池中,电极II为阳极,电极反应式为:4OH- - 4e- = O2↑+ 2H2O,氧气在电极II生成,此时电极III为阴极,NiOOH中Ni为+3价,Ni(OH)2中Ni为+2价,则NiOOH是反应物,Ni(OH)2是生成物;当开关闭合到K1时,电极III为阳极,NiOOH是生成物,Ni(OH)2是反应物,电极I为阴极,阴极反应式为:2H2O + 2e- = H2↑+2OH-,氢气在电极I生成,据此解答。
该装置为电解池,通过控制开关连接K1或K2电解水,可交替得到H2和O2,在电解池中,阳极发生失电子的氧化反应,阴极发生得电子的还原反应。当开关闭合到K2时,所形成的电解池中,电极II为阳极,电极反应式为:4OH- - 4e- = O2↑ + 2H2O,氧气在电极II生成,此时电极III为阴极,NiOOH中Ni为+3价,Ni(OH)2中Ni为+2价,则NiOOH是反应物,Ni(OH)2是生成物;当开关闭合到K1时,电极III为阳极,NiOOH是生成物,Ni(OH)2是反应物,电极I为阴极,电极反应式为:2H2O + 2e- = H2↑+2OH-,氢气在电极I生成。
A. 由以上分析可知,H2在阴极生成,连接到K1时,电极I为阴极,得到的气体为氢气,A项错误;
B. 连接K1时,电极Ⅰ为阴极,电极反应式为:2H2O + 2e- = H2+2OH-,则电极附近碱性增强,B项错误;
C. 氧气在电极II生成,开关闭合到K2,此时电极III为阴极,电极Ⅲ的反应为:NiOOH+e+H2O=Ni(OH)2+OH-,C项正确;
D. 当开关闭合到K2时,电极III为阴极,电极III反应式为:NiOOH+e+H2O=Ni(OH)2+OH-;当开关闭合到K1时,电极III为阳极,电极III反应式为:Ni(OH)2 - e+OH-=NiOOH+H2O,则通过控制开关连接K1和K2,可使电极Ⅲ循环使用,D项正确;
答案选CD。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于电解质、非电解质的说法正确的是:
A.氯气溶于水得氯水,该溶液能导电,因此氯气是电解质
B.CaCO3![]() 饱和溶液导电能力很弱,故CaCO3是弱电解质
饱和溶液导电能力很弱,故CaCO3是弱电解质
C.HF的水溶液中既有H+、F+,又有大量的HF分子,因此HF是弱电解质
D.导电能力弱的溶液肯定是弱电解质的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
①加热盛有二氧化锰、浓盐酸的烧瓶,瓶内充满黄绿色气体。
②氯气的密度比空气大,常用向上排空气法收集氯气。
③闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔。
④在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色。
⑤氯气易液化,在低温和加压的条件下可以转变为液态(液氯)和固态。
⑥氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物有广泛用途。二氧化氯是一种新型的消毒剂。
①NaClO2中Cl的化合价为____________。
②实验室用氯酸钾与浓盐酸反应制备ClO2,产物除ClO2外,还有Cl2,KCl等,写出该反应的化学方程式 __________。若生成11.2L氯气(标准状况),转移电子数为 _________。
③ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的_________倍。
④自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8 mgL-1之间。碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
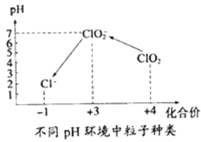
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(己知:2S2O32-+I2═S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1﹣3。
请问答:
若水样的体积为1.0L,在操作II时消耗了1.0×10-3molL-1的Na2S2O3溶液10mL.则水样中ClO2的浓度是_____ mgL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 请回答下列问题:

(1)写出①、②反应的离子方程式
①__________________________________________;
②________________________________________________________
(2)在点燃H2之前必须先进行_______________________________________。
(3)实验小组在点燃用上述装置制得的H2时,①实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因___________________________________________________________________
(4)实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。在改进后的实验中H2的生成速率会_______________。改进后的实验现象为_________________________________________________________________________。
(5)2.3 g钠投入20 mL水中完全反应放出的气体在标准状况下的体积是____________,所得溶液的物质的量浓度是______________________。(不计溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
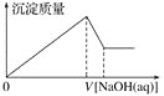
A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡。合金中铁和银的质量比为( )
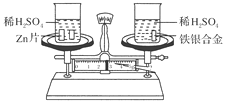
A.65 ∶56B.56 ∶108
C.56 ∶9D.65 ∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() ,不同温度下,容器中
,不同温度下,容器中![]() 浓度与反应时间的关系如图所示,下列说法正确的是( )
浓度与反应时间的关系如图所示,下列说法正确的是( )
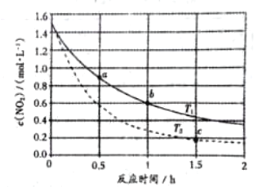
A.![]()
B.![]() 点的正反应速率大于
点的正反应速率大于![]() 点的逆反应速率
点的逆反应速率
C.![]() 点的反应速率小于
点的反应速率小于![]() 点的反应速率
点的反应速率
D.![]() 点时
点时![]() 的浓度为
的浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 2NO2(g)![]() N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成 n mol N2O4 的同时生成 2n mol NO2
②单位时间内消耗 n mol N2O4的同时生成 2n mol NO2
③用NO2、N2O4的物质的量浓度变化表示的反应速率的比为2:1 的状态
④混合气体的颜色不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A. ①④⑤B. ②⑤C. ①③④D. ①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com