
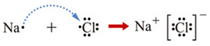
分析 A、B、C、D、E、F、G是原子序数依次增大的六种短周期元素.B、D、G的最高价氧化物对应水化物两两之间都能反应,可知D为Al,B为Na,C为Mg;A和B能够形成B2A和B2A2 两种化合物,则A为O元素;D、F、G 原子最外层电子数之和等于15,则F、G的最外层电子数之和为15-3=12,F应为P,G为Cl,可知E为Si,以此来解答.
解答 解:(1)B为Na,位于第3周期 第ⅠA族,故答案为:第3周期 第ⅠA族;
(2)BG为NaCl,用电子式表示化合物的形成过程为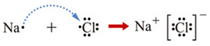 ,故答案为:
,故答案为: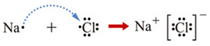 ;
;
(3)Na2O2中含有离子键和共价键,故答案为:离子;共价;
(4)a.同周期从左向右原子半径减小,则B、D、E 原子半径依次减小,故正确;
b.O无正价,只有5种元素的最高正化合价均等于其原子的最外层电子数,故错误;
c.E的单质为半导体材料,是人类将太阳能转化为电能的常用材料,故正确;
d.非金属性越强,对应氢化物越稳定,则元素气态氢化物的稳定性A>G>F,故错误;
故答案为:ac;
(5)非金属性G>F,则最高价氧化物对应的水化物酸性强弱:F<G,用原子结构解释原因:同周期元素电子层数相同,从左到右核电荷数逐渐增多,原子半径逐渐减小,得电子能力逐渐增强,元素非金属性逐渐增强,
故答案为:<; 核电荷数逐渐增多,原子半径逐渐减小,得电子能力逐渐增强;
(6)反应结束冷却到室温,只有四氯化碳为液体,其它为固体,则回收CCl4的实验操作名称为过滤,除去粗产品中少量的单质B的反应为2Na+2CH3CH2OH→2CH3CH2ONa+H2↑,故答案为:过滤;2Na+2CH3CH2OH→2CH3CH2ONa+H2↑.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识推断元素为解答的关键,侧重分析与推断、应用能力的考查,注意化学用语及规律性知识的应用,综合性较强,题目难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
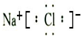 ,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.
,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.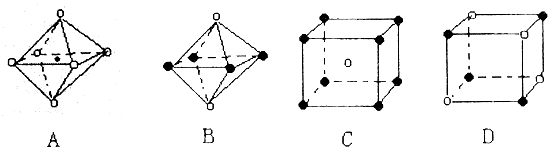
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中可能含有乙烷 | D. | 混合气体中一定没有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系:
气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+有较强的吸附性 | |
| B. | Al3+与悬浮物生成沉淀 | |
| C. | Al3+与水反应生成的氢氧化铝胶体,具有吸附性 | |
| D. | 明矾难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
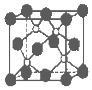 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )| A. | 磷化硼晶体的化学式为BP,属于离子晶体 | |
| B. | 磷化硼晶体的熔点高,且熔融状态下能导电 | |
| C. | 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 | |
| D. | 磷化硼晶体中每个原子均形成4个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:3:2 | B. | 2:2:3 | C. | 3:28:27 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、烧碱均属碱 | B. | SiO2、CO2均属于酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com