
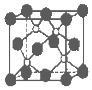
 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )| A. | 磷化硼晶体的化学式为BP,属于离子晶体 | |
| B. | 磷化硼晶体的熔点高,且熔融状态下能导电 | |
| C. | 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 | |
| D. | 磷化硼晶体中每个原子均形成4个共价键 |
分析 A.利用均摊法计算化学式,根据磷化硼是一种超硬耐磨涂层材料,判断晶体类型;
B.根据磷化硼是原子晶体判断其熔点高,且熔融状态下不能导电;
C.根据磷化硼晶胞结构结合NaCl晶胞结构中阴阳离子的配位数均为6判断;
D.根据晶胞得出配位数为4判断.
解答 解:A.晶胞中:P位于顶点和面心,数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,由于磷化硼是一种超硬耐磨涂层材料,属于原子晶体,故A错误;
B.磷化硼晶体是原子晶体,熔点高,但熔融状态下没有自由的离子所以不能导电,故B错误;
C.该晶胞配位数为4,而NaCl晶胞结构中阴阳离子的配位数均为6,所以磷化硼晶体结构微粒的空间堆积方式与氯化钠不相同,故C错误;
D.该晶胞配位数为4,即每个原子均形成4条共价键,故D正确;
故选D.
点评 本题考查晶胞计算、晶胞配位数和晶胞堆积方式,难度不大,必须牢固掌握基础知识.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
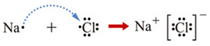
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
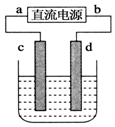 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )| A. | a是电源的正极 | B. | 电子流动的方向:d→b | ||
| C. | c极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧,看火焰是否为黄色 | B. | 滴加盐酸,看是否有气体产生 | ||
| C. | 溶解后测定溶液是否为碱性 | D. | 加热,看是否有气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com