
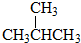 和
和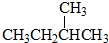
 和
和
| 类别 | 同位素 | 同素异形体 | 同系物 | 同分异构体 |
| 组号 |
分析 根据同位素、同系物、同素异形体、同分异构体的概念判断,同位素的对象是原子,是同种元素不同原子;同素异形体的对象是单质,即同种元素形成的不同单质;若化学式为分子式相同、结构不同的有机化合物,则为同分异构体;若是分子式不同结构相似的有机化合物,则为同系物.
解答 解:同位素的对象是原子,是同种元素不同原子;同素异形体的对象是单质,即同种元素形成的不同单质;若化学式为分子式相同、结构不同的有机化合物,则为同分异构体;若是分子式不同结构相似的有机化合物,则为同系物,所以①为同系物; ②为同分异构体;③为同系物;④为同素异形体;⑤为同位素;⑥为同位素;⑦为同分异构体;⑧为同素异形体,
故答案为:
| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 | ⑤⑥ | ①③ | ④⑧ | ②⑦ |
点评 本题考查了同位素、同素异形体、同分异构体、同系物的判断方法,注意概念的把握,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | FeS2既是氧化剂,又是还原剂 | |
| B. | FeSO4溶液保存过程中需加稀硫酸和铁粉,防止变质 | |
| C. | 每生产1molFeSO4,转移的电子数为28NA | |
| D. | 硫酸工业中煅烧黄铁矿,其氧化产物只有SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3→Na2SiO3 | B. | SiO2→H2SiO3 | C. | Cu→CuSO4 | D. | SiO2→Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H、D、T互为同位素 | B. | 金刚石、石墨、C60互为同分异构体 | ||
| C. | SO2和SO3互为同分异构体 | D. | 正丁烷和异丁烷互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com