
【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
T℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)上述反应为____(填“放热”或“吸热”)反应,升高温度,平衡向______ (填“正反应”或“逆反应”) 方向移动。
(2)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(B)发生上述应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=______mol·L-1·min-l。
②该温度下反应的平衡常数K=______.
(3)生产水煤气的过程如下:
①C(s)+CO2(g) ![]() 2CO(g)ΔH1
2CO(g)ΔH1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
③反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述错误的是
A.SO2可用于杀菌消毒,是一种食品添加剂
B.液氨常用作制冷剂,是因为氨气液化时要吸收大量的热
C.硅单质具有良好的半导体性能,可制成计算机的芯片
D.硫酸铵、碳酸氢铵等铵盐是农业上常用的化肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为________________________________________。
(2)B的氢化物的结构是____________________________,其空间构型为____________________________________________________。
(3)E核外电子排布式是__________________,E的某种化合物的结构如下图所示。
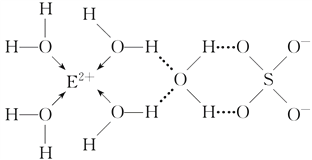
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有______________________。
(4)A与B的气态氢化物的沸点________更高,A与D的气态氢化物的沸点________更高。
(5)A的稳定氧化物中,中心原子的杂化类型为________,空间构型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
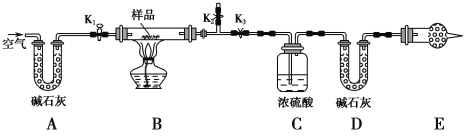
(1) 实验步骤:
① 按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
② 称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是___________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________________________、______________________________。
⑤ 打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2) 关于该实验方案,请回答下列问题。
① E处干燥管中盛放的药品是________,其作用是______________________________________,如果实验中没有该装置,则可能导致测量结果NaHCO3的质量分数________(填“偏大”“偏小”或“无影响”)。
② 若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为__________________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一组是
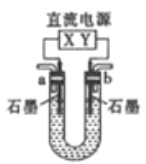
选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-=O2↑+2H2O |
C | 负极 | CuCl2溶液 | b管中有气体逸出 |
D | 负极 | NaOH溶液 | 溶液PH降低 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.03×1023个CH4中,含____mol碳原子,____mol氢原子,____mol质子,____mol电子。与____个NH3含有相同数目的氢原子。标准状况下CH4所占的体积为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪90年代初,国际上提出“预防污染”这一新概念,绿色化学是预防污染的基本手段,下列各项属于绿色化学的是
A.减少有毒物B.治理污染点C.处理废弃物D.杜绝污染源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。

(1)在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的钛离子、钙离子各有__________个、__________个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构如图中正方体边长(钛原子之间的距离)为d nm(1 nm=1×10-9 m),则该晶体的密度为__________g/cm3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据最近媒体报道,化学研究人员开发了一种可充电锌空气电池,这种电池的电解质溶液为KOH溶液,储电量是锂电池的五倍,而且更安全、更环保,未来或许可以取代锂电池,用在智能手机等电子设备中,其反应原理为2Zn+O2+4KOH+2H2O![]() 2K2Zn(OH)4。下列说法正确的是
2K2Zn(OH)4。下列说法正确的是
A. 放电时,负极反应式为Zn+2e-4OH-=Zn(OH)↓
B. 放电时,电路中通过4mol电子,消耗22.4L氧气
C. 充电时,电解质溶液中OH-浓度逐渐增大
D. 充电时,电解质溶液中K+向正极移动,且发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com