
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源:2015-2016年海南省高一上第三次月考化学试卷(解析版) 题型:填空题
为了确认电解质溶液X的成分,某同学做了以下两组实验,请根据实验回答问题:
编号 | I | II |
实验一 |
|
|
编号 | III | |
实验二 |
| |
(1)实验步骤I中无明显现象,实验步骤II中发现溶液变红色,相关的离子方程式为:_______________________;
(2)实验步骤III中反应的离子方程式为:___________________________;
(3)实验一证明X溶液中含__________离子,实验II证明X溶液中含_________离子。(填离子符号)
查看答案和解析>>
科目:高中化学 来源:2015-2016年江西省高二上12月月考化学试卷(解析版) 题型:选择题
如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是
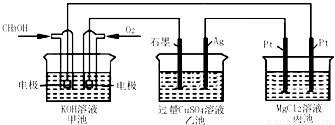
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源:2015-2016年江西省高二上12月月考化学试卷(解析版) 题型:选择题
反应A(g)+B(g) C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
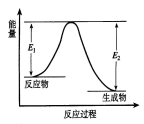
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H < 0,反应达到平衡时,升高温度,A的转化率增大
D.△H > 0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目:高中化学 来源:2015-2016年山东省高一上12月月考化学试卷(解析版) 题型:推断题
氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
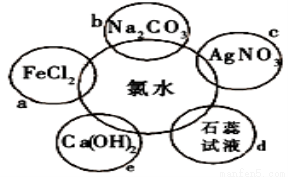
(1)a、b、c中反应的离子方程为_________________、___________、 _____________。e中的化学反应方程式______________,上述反应中发生了氧化还原反应的是: __________________ (填“a”、“b”、“c”或“e”)。
(2)能证明氯水具有漂白性的现象是 。
(3)久置的氯水变为______,用化学反应方程式表示为 。
(4)实验室保存饱和氯水的方法是_____ __。
(5)证明氯水与 a反应所需的试剂____ ___。
查看答案和解析>>
科目:高中化学 来源:2015-2016年山东省高一上12月月考化学试卷(解析版) 题型:选择题
若NA表示阿伏伽德罗常数的值,下列说法正确的是
A.0.1mol/L的 CaCl2溶液中所含Cl﹣数为0.2NA
B.7.8g Na2O2与足量水反应,转移电子数为0.2NA
C.常温常压下,8g CH4含有的分子数为0.5NA
D.常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016年山西省高一上12月月考化学试卷(解析版) 题型:推断题
X、Y、Z、W四种化合物均由元素周期表前18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。

请回答:
(1)W的化学式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中生成白色沉淀,装置V中可收集到一种无色气体。
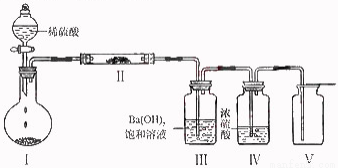
①装置I中反应的化学方程式是 。装置II中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的位置V中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要装置,填写编号)。
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西省高二上12月月考化学试卷(教师版) 题型:填空题
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I)反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
TaI4(g)+S2(g)△H﹥0 (I)反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
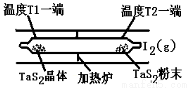
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 。
(4)25℃时,H2SO3  HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中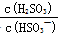 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上期中考试化学试卷(解析版) 题型:选择题
在密闭容器中充入4molHI,在一定温度下2HI(g)  H2(g) +I2(g)达到平衡时,有30%的HI发生分解,则平衡时混合气体总的物质的量是( )
H2(g) +I2(g)达到平衡时,有30%的HI发生分解,则平衡时混合气体总的物质的量是( )
A.4mol B.3.4mol C.2.8mol D.1.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com