
【题目】TMB由碳氢氮三种元素组成,其相对分子质量为240,是一种新型指纹检测的色原试剂,已在逐步取代强致癌物联苯胺和其他致癌性的联苯胺衍生物应用于临床化验法医检验刑事侦破及环境监测等领域。某研究小组欲利用燃烧法测定TMB的分子式(氮元素转化为N2)实验装置如图所示。回答下列问题:
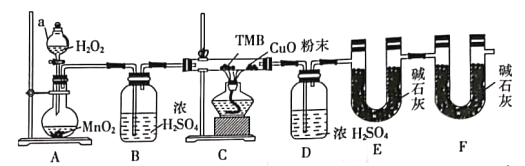
(1)实验装置两处用到装有碱石灰的干燥管,其中F处的目的是______________________。仪器a的名称是___________。
(2)将足量双氧水置于a中,圆底烧瓶中装入MnO2固体,按图连接好装置。
①A中发生反应的化学方程式为______________________。
②待B、D处导管口有均匀气泡时,再点燃C处酒精灯,原因是______________________。
(3)装置C中CuO粉末的作用为_________________________________。
(4)该实验___________(填“需要”或“不需要”)尾气处理,其原因是____________________。
(5)理想状态下,将4.80gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60g,E增加14.08g,则TMB的分子式为___________。
【答案】防止外界空气中的CO2和H2O进入E中,避免对E处吸收CO2的定量检测造成干扰; 分液漏斗 2H2O2![]() 2H2O+O2↑ 排除装置内原有的CO2和水蒸气 使TMB不充分燃烧生成CO全部转化为CO2 不需要 碳元素必须燃烧完全才能保证实验结果的准确性,无有毒气体排放 C16H20N2
2H2O+O2↑ 排除装置内原有的CO2和水蒸气 使TMB不充分燃烧生成CO全部转化为CO2 不需要 碳元素必须燃烧完全才能保证实验结果的准确性,无有毒气体排放 C16H20N2
【解析】
(1)利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳进入E装置中,影响测量结果;根据仪器的结构判断写出名称;
(2)①双氧水在二氧化锰催化下分解生成水和氧气;
②氧气排除装置内原有的CO2和水蒸气;
(3) CO与CuO发生氧化还原反应生成铜和CO2;
(4)因碳元素完全转化为二氧化碳,且生成氮气,没有必要进行尾气处理;
(5)实验结束时测得D增加3.60g,E增加14.08g,则燃烧生成的m(H2O)=3.60g、m(CO2)=14.08g,则n(H2O)=![]() =0.2mol,n(H)=0.4mol,n(CO2)=
=0.2mol,n(H)=0.4mol,n(CO2)=![]() =0.32mol,n(C)=0.32mol,所以m(N)=4.80g-0.32mol×12g/mol-0.4mol×1g/mol=0.56g,n(N)=
=0.32mol,n(C)=0.32mol,所以m(N)=4.80g-0.32mol×12g/mol-0.4mol×1g/mol=0.56g,n(N)=![]() =0.04mol,则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,依据相对分子质量计算分子式。
=0.04mol,则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,依据相对分子质量计算分子式。
(1)利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳进入E装置中,影响测量结果;
根据仪器的结构可知,通过仪器a加入液体反应物并控制加入的量,故仪器a的名称是分液漏斗;
(2)①A中双氧水在二氧化锰催化下分解生成水和氧气,发生反应的化学方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
②待B、D处导管口有均匀气泡时,得到纯净的干燥的氧气进入装置C中,氧气排除装置内原有的CO2和水蒸气后,再点燃C处酒精灯;
(3)装置C中CuO粉末的作用为使TMB不充分燃烧生成CO全部转化为CO2;
(4)碳元素必须燃烧完全才能保证实验结果的准确性,无有毒气体排放,故该实验不需要尾气处理;
(5)实验结束时测得D增加3.60g,E增加14.08g,则燃烧生成的m(H2O)=3.60g、m(CO2)=14.08g,则n(H2O)=![]() =0.2mol,n(H)=0.4mol,n(CO2)=
=0.2mol,n(H)=0.4mol,n(CO2)=![]() =0.32mol,n(C)=0.32mol,所以m(N)=4.80g-0.32mol×12g/mol-0.4mol×1g/mol=0.56g,n(N)=
=0.32mol,n(C)=0.32mol,所以m(N)=4.80g-0.32mol×12g/mol-0.4mol×1g/mol=0.56g,n(N)=![]() =0.04mol,则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,TMB的相对分子质量为240,设分子式为:C8nH10nNn,则有:12×8n+10n+14n=240,解得n=2,所以分子式为C16H20N2。
=0.04mol,则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,TMB的相对分子质量为240,设分子式为:C8nH10nNn,则有:12×8n+10n+14n=240,解得n=2,所以分子式为C16H20N2。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值(NA)有关的说法中,不正确的是
A. 18g H218O与D2O的混合物中,中子数为9NA
B. 标准状况下,22.4 L Cl2与NaOH溶液完全反应时转移电子的数为NA
C. 1L0.1 mol L-1NH4NO3溶液中加稀氨水,溶液呈中性时NH![]() 数为0.1NA
数为0.1NA
D. 4.6 gC2H6O中含有的C—H数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol/LCH3COOH溶液加水稀释或升高温度的过程中,下列表达式的数值一定变大的是
A. c(H+) B. c(H+)·c(OH-) C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种正投入生产的大型蓄电系统如图所示。放电前,被交换膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述不正确的是

A. 放电时,负极的电极反应式为2S22――2e-===S42-
B. 充电时,阳极的电极反应式为3Br--2e-===Br3-
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 充电时,M接电源负极,N接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是______;B中所含官能团的名称是______。
(2)反应⑤的化学方程式为______,该反应的反应类型是______。
(3)G的分子式为______。
(4)写出满足下列条件的E的同分异构体的结构简式:______、______。
Ⅰ.苯环上只有三个取代基
Ⅱ核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备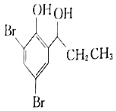 的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2—二氯乙烷的是( )
A. 乙烷与氯气光照反应B. 乙烯与氯化氢气体混合
C. 乙烯通入浓盐酸D. 乙烯与氯气混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢气的热化学方程式分别为______________________________、__________________________________,制得等量H2所需能量较少的是系统______。(填Ⅰ或Ⅱ)
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入容积为2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入容积为2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
①H2S的平衡转化率α=_______%,反应平衡常数K=________。(用分数表示)
②在620 K重复上述试验,平衡后水的物质的量分数为0.05,H2S的转化率α2______α1,该反应的△H_____0。(填“>”“<”或“=”)
③向上述反应器中再分别充入下列气体,能使H2S转化率增大的是________。(填标号)
A. H2S B. CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL-1氨水中加入少量水,pH减小,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Kb(NH3·H2O)=1.76×10-5。25℃时,分别向浓度均为0.1mol/L,体积均为20mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c水(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是

A. HX的电离方程式为HX==H++X-
B. b点时溶液中c(NH4+)=c(Y-)>c(H+)=c(OH-)
C. 其中一种酸的电离度为0.1%
D. a点溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com