
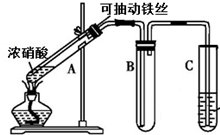
 某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.分析 (1)铁丝遇冷、浓硝酸发生钝化;
(2)反应生成硝酸铁、NO2,生成硝酸盐体现酸性,生成NO2时N元素的化合价降低,生成NO2污染空气,用碱液吸收;
(3)根据铁元素的化合价提出合理假设;
(4)根据+2价的铁元素具有还原性,能使紫色的酸性KMnO4溶液腿色,+3价的铁元素与KSCN溶液形成红色溶液进行解答;
(5)根据氧化还原反应的原理以及质量守恒可写出反应方程式.
解答 解:(1)铁丝遇浓硝酸没有明显现象,其原因是浓硝酸使铁钝化,
故答案为:浓硝酸使铁钝化;
(2)因硝酸中的N元素的化合价为+5价,NO2中N元素的化合价为+4价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸与硝酸中N元素的化合价相同,则体现硝酸具有酸性,生成NO2污染空气,用碱液吸收
故答案为:氧化性;酸性;NaOH;
(3)根据铁元素的化合价有+2、+3,有三种可能,故还原产物中只有+2价铁,
故答案为:产物中只有+2价铁;
(4)根据+2价的铁元素具有还原性,能使紫色的酸性KMnO4溶液褪色,+3价的铁元素与KSCN溶液形成红色溶液,所以预期现象和结论:
①甲试管溶液无明显变化,乙试管溶液变红色,则产物只有+3价铁,
故答案为:溶液变红色;
②+2价的铁元素具有还原性,能使紫色的酸性KMnO4溶液褪色,若甲试管溶液紫色褪去,乙试管没有明显变化,则产物中只有+2价铁元素,
故答案为:溶液紫色褪去;
(5)该小组某次实验产物,经检测仅含Fe3+,装置A中生成NO反应的离子方程式:Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O.
点评 本题考查了铁及其化合物性质,题目难度中等,明确铁离子、亚铁离子的检验方法为解答关键,注意掌握性质实验方案设计与评价的原则.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦ | B. | ①⑤ | C. | ②⑤⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明朝的《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露.”该段文字记载了白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯 | |
| B. | 汉朝的《淮南万毕术》、《神农本草经》记载“白青(碱式碳酸铜)得铁化为铜”,“石胆…能化铁为铜”都是指铜可以采用湿法冶炼 | |
| C. | 清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之.”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 | |
| D. | 晋代葛洪的《抱朴子》记载“丹砂烧之成水银,积变又成丹砂”,是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知FeO4n-中Fe的化合价是+6价,则n=2 | |
| B. | 每产生1molCl-,转移2mol电子 | |
| C. | FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂 | |
| D. | 若n=2,该反应中氧化剂与还原剂的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
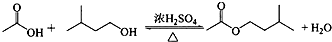
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| , | 实验操作 | 预期现象 | 结 论 |
| 验证猜想I] | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 | 含有Fe2+ |
| 步骤②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不变为蓝色 | 不含Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置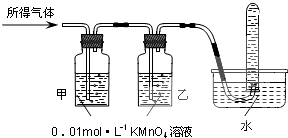 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
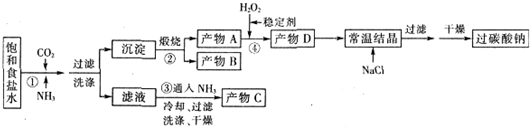

| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com