
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A. 原子核内有10个中子的氧原子:18O B. 乙烯的结构简式: CH2CH2
C. CH4分子的比例模型: D. -CH3(甲基)的电子式为:
D. -CH3(甲基)的电子式为:
科目:高中化学 来源:湖南省长沙市2016-2017学年高一上学期期末考试化学试卷 题型:选择题
向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
查看答案和解析>>
科目:高中化学 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:简答题
汽车尾气中的主要污染物是NO、NO2和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
[研究一]用NaOH溶液吸收NO、NO2,
⑴当n(NO)﹕n(NO2)=1时只生成一种盐,这种盐的化学式为__________
⑵当只有NO2时,生成两种盐:2NO2+2NaOH=NaNO2+NaNO3+H2O。若NaOH溶液恰好完全吸收NO2后溶液显碱性,该溶液中离子浓度由大到小的顺序是:___________。
[研究二]一定条件将CO和NO转化为无污染产物:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
⑶已知:2C(s)+O2(g)=2CO(g);△H1=-221.0KJ/mol
C(s)+O2(g)=CO2(g);△H2=-393.5KJ/mol
N2(g)+O2(g)=2NO(g);△H3=+180.5KJ/mol。
则△H=______
⑷T℃下,在固定容积的密闭容器中,通入一定量NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) 10?4 mol/L | 10.0 | 4.50 | 2.00 | 1.50 | 1.00 | 1.00 |
c(CO) 10?3 mol/L | 3.60 | 3.05 | 2.80 | 2.75 | 2.70 | 2.70 |
①该条件下,2s内N2的平均反应速率v(N2)=_____________
②若往容器中加入一定量生石灰,CO平衡转化率_____(选填“增大”、“减小”或“不变”)
③其它条件不变,只适当升高温度,则4s时,c(NO)=c1mol/L,则c1可能是_______
a.1.10×10﹣3 b.1.25×10﹣4 c.1.00×10﹣4 d.9.00×10﹣5
【研究三】测定汽车尾气中CO的含量
⑸用CO分析仪测定:该分析仪的工作原理类似于燃料电池,其中电解质是能传导O2﹣的Y2O3和ZrO2晶体,负极的电极反应式为____________。
⑹用五氧化二碘(I2O5)固体氧化定量检测:I2O5+5CO=I2+5CO2
抽取10L汽车尾气,用足量I2O5吸收,然后配成100mL溶液,量取其中的20.00mL溶液,用0.0050mol/LNa2S2O3溶液滴定,三次平行实验平均消耗Na2S2O3溶液的体积为20.00mL,已知:2Na2S2O3+I2=Na2S4O6+2NaI,则尾气中c(CO)=___________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
某单烯烃与H2加成后的产物是: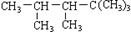 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
A. 3种 B. 4种 C. 5种 D. 2种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于苯的性质的叙述中,不正确的是( )
A. 苯是无色、带有特殊气味的液体
B. 常温下苯是不溶于水且密度小于水的液体
C. 苯在一定条件下能与溴发生取代反应
D. 苯不具有典型的双键所应具有的加成反应的性质,故不可能发生加成反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省揭阳市高二下学期第一次月考理科综合化学试卷(解析版) 题型:实验题
某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取粗铜和绿矾(FeSO4·7H2O)产品,设计流程如下:
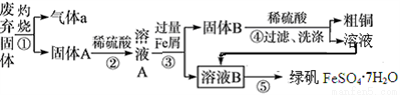
(1)气体a为_______
(2)固体B的主要成分为_______
(3)溶液B在空气中放置有可能变质,如何检验溶液B是否变质:_______
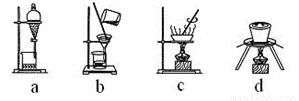
(4)下列实验操作中,步骤⑤中需要用到的是_______(填字母)。
(5)为测定产品中绿矾的质量分数,称取40.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.80 | 20.02 | 19.98 | 20.00 |
① 请写出有关滴定的离子方程式_______
② 第1组实验数据出现异常,造成这种异常的原因可能是_______(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗 b.锥形瓶洗净后未干燥
c.滴定前尖嘴有气泡,滴定后气泡消失 d.滴定终点时俯视读数
③ 根据表中数据,计算所得产品中绿矾的质量分数为_______ (保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省揭阳市高二下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
化学与生活、生产息息相关,下列说法正确的是( )
A. 误服Al3+、Cu2+、Hg2+等重金属离子会使蛋白质变性而中毒
B. 家庭装修材料中散发出来的甲醛会严重污染居室环境
C. 冬季燃烧煤炭供热取暖与雾霾天气的形成没有必然联系
D. 镁、铝的氧化物和氢氧化物都是优质的耐高温材料
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:简答题
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。
(1)制备莫尔盐的流程如下:
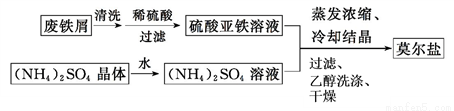
①用热的Na2CO3溶液清洗废铁屑的目的是__________。
②其中最后一步用少量无水乙醇洗涤晶体目的是________。
(2)现取0.4gCu2S和CuS的混合物在酸性溶液中用40mL0.150mol·L-1KMnO4溶液处理,发生反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,
反应后煮沸溶液,赶尽SO2,剩余的KMnO4用0.2mol·L-1(NH4)2Fe(SO4)2溶液来滴定,完全反应消耗(NH4)2Fe(SO4)2溶液VmL。已知:MnO4-+Fe2++H+→Mn2++Fe3++H2O(未配平)
①滴定终点的现象为________。
②若V=35,试计算混合物中CuS的质量分数________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且可以再生。下列最有希望的新能源是
①天然气 ②煤 ③石油 ④太阳能 ⑤氢能
A. ①③⑤ B. ②③④ C. ①④⑤ D. ④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com