
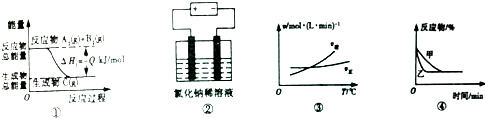
| A. | 图①表示可逆反应A2(g)+B2(g)?C(g)的△H1大于0 | |
| B. | 图②是电解氯化钠稀溶液的电解池,其中阴、阳极产生气体的体积之比一定为1:1 | |
| C. | 图③表示可逆反应A2(g)+3B2(g)?2AB3(g)的△H小于0 | |
| D. | 图④表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙曲线对应的压强大 |
分析 A.图①反应物总能量大于生成物总能量,反应放热;
B.图②电解氯化钠稀溶液,阳极开始生成Cl2,之后生成O2;
C.图③随着温度的升高,逆反应速率大于正反应速率,平衡向逆方向进行;
D.图④表示催化剂对可逆反应的影响.
解答 解:A.图①反应物总能量大于生成物总能量,反应放热,则△H小于0,故A错误;
B.图②电解氯化钠稀溶液,阳极开始生成Cl2,之后生成O2,如电解时间较长,则阴、阳极产生气体体积之比大于1:1,故B错误;
C.图③随着温度的升高,逆反应速率大于正反应速率,平衡向逆方向进行,说明反应放热,则△H小于0,故C正确;
D.图④中甲乙两途径平衡状态相同,则应是催化剂对可逆反应的影响,故D错误.
故选C.
点评 本题考查较为综合,题目难度中等,易错点为B,注意点解氯化钠稀溶液的特点,正确判断两极反应是解答该题的关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝钠合金的熔点比铝低 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,放出的H 2 越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:Na2CO3>NaHCO3 | B. | 熔点:生铁>纯铁 | ||
| C. | 酸性:H2CO3>HClO | D. | 氧化性:Fe3+>Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、AlO2-、Cl-、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼是原子晶体 | |
| B. | 熔化时,氯化硼能导电 | |
| C. | 硼原子以sp3杂化 | |
| D. | 水解方程式:BCl3+3H2O═H3BO3+3HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25(b-2a)mol/L | B. | 4(2a-b)mol/L | C. | 2(b-2a)mol/L | D. | 4(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
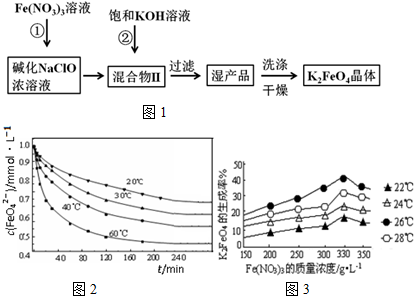
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com