
| A. | 铝钠合金的熔点比铝低 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,放出的H 2 越多,则铝的质量分数越小 |
分析 合金是一种金属与其它金属或非金属熔合而成具有金属特性的物质,是混合物,其硬度比纯金属大,熔点比纯金属低,据此解答.
解答 解:A.合金熔点低于成分金属熔点,所以铝钠合金的熔点比铝低,故A正确;
B.铝钠合金若投入一定的水中可得无色溶液,说明钠和水反应生成的氢氧化钠足以将金属铝溶解,则n(Al)≤n(Na),故B正确;
C.铝钠合金投入到足量氯化铜溶液中,钠和水反应生成的氢氧化钠可以和氯化铜反应生成氢氧化铜沉淀,若n(Al)>n(Na),金属铝也可能会置换出金属铜,故C正确;
D.根据金属钠和金属铝和酸反应生成氢气量的关系:2Al~3H2↑,2Na~H2↑,等质量的金属钠和金属铝,则金属Al产生的氢气量多,所以放出的H2越多,则铝的质量分数越大,故D错误;
故选D.
点评 本题考查了合金的性质,熟悉合金概念及特性是解题关键,注意钠、铝的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| B. | 标准状况下,35.5 g 氯气与足量红热的铁充分反应得到的电子数一定为NA | |
| C. | 标准状况下,2.24 L HF中含有的原子数为0.2NA | |
| D. | 在密闭容器中加入0.5 moL N2和1.5 moL H2,充分反应后容器中的N-H键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 100mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| B | 0.01molK2O | 溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(O{H}^{-})}$ 增大 |
| C | 50mL 1mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| D | 0.1molKHSO4固体 | 反应结束后,溶液pH=7 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
 +2H2O→2
+2H2O→2 +H2O2;
+H2O2; )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;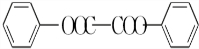 (或
(或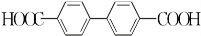 或
或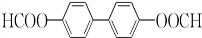 .;
.;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
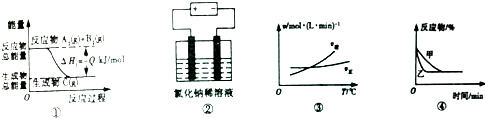
| A. | 图①表示可逆反应A2(g)+B2(g)?C(g)的△H1大于0 | |
| B. | 图②是电解氯化钠稀溶液的电解池,其中阴、阳极产生气体的体积之比一定为1:1 | |
| C. | 图③表示可逆反应A2(g)+3B2(g)?2AB3(g)的△H小于0 | |
| D. | 图④表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙曲线对应的压强大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com