
【题目】亚氯酸钠常用作漂白剂。某化学小组设计实验制备亚氯酸钠,并进行杂质分析。
实验I 按图装置制备NaC1O2晶体
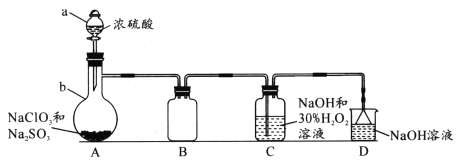
已知:①C1O2为黄绿色气体,极易与水反应。
②NaC1O2饱和溶液在低于38℃时析出NaC1O2·3H2O晶体,高于38℃时析出NaC1O2晶体,温度高于60℃时NaC1O2分解生成NaC1O3和NaCl。
(1)装置A中b仪器的名称是____;a中能否用稀硫酸代替浓硫酸____(填“能”或“不能”),原因是____。
(2)A中生成C1O2的化学反应方程式为____。
(3)C中生成NaC1O2时H2O2的作用是____;为获得更多的NaC1O2,需在C处添加装置进行改进,措施为____。
(4)反应后,经下列步骤可从C装置的溶液中获得NaC1O2晶体,请补充完善。
i.55℃时蒸发结晶 ii.__________ ii.用40℃热水洗涤 iv.低于60℃干燥,得到成品
实验Ⅱ 样品杂质分析
(5)上述实验中制得的NaC1O2晶体中还可能含有少量中学常见的含硫钠盐,其化学式为____,实验中可减少该杂质产生的操作(或方法)是____(写一条)。
【答案】蒸馏烧瓶 不能 ClO2极易与稀硫酸中的水反应,影响NaC1O2产率 2NaC1O3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O 作还原剂 将C装置放置于水浴中进行反应,控制温度在38℃~60℃ 趁热过滤(或38℃以上过滤) Na2SO4 控制浓硫酸滴速(或缓慢滴加浓硫酸或混合固体混合物时加入过量的NaC1O3等)
【解析】
装置A中制备得到ClO2,所以A中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,二氧化氯和氢氧化钠反应生成NaClO2,A中可能发生Na2SO3+ H2SO4(浓)= Na2SO4+SO2↑+H2O,产生的SO2被带入C中与NaOH反应生成Na2SO3,Na2SO3与H2O2反应生成Na2SO4,由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;装置B的作用是安全瓶,有防倒吸作用,从装置C的溶液获得NaClO2晶体,需要蒸发结晶、趁热过滤、洗涤、干燥,装置D是吸收多余气体防止污染。据此解答。
(1)根据仪器构造,装置A中b仪器的名称是蒸馏烧瓶;A中反应为氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯。由信息可知,C1O2极易与水反应,所以a中不能用稀硫酸代替浓硫酸,防止ClO2与稀硫酸中的水反应,影响NaC1O2产率。
故答案为:蒸馏烧瓶;不能;ClO2极易与稀硫酸中的水反应,影响NaC1O2产率;
(2)A中氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式应为2NaC1O3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,
故答案为:2NaC1O3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;
(3)C中二氧化氯和氢氧化钠反应生成NaClO2,氯元素化合价从+4价降到+3价,二氧化氯被还原,所以C中生成NaC1O2时H2O2的作用是作还原剂;
由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以为获得更多的NaC1O2,将C装置放置于水浴中进行反应,控制温度在38℃~60℃。
故答案为:作还原剂;将C装置放置于水浴中进行反应,控制温度在38℃~60℃;
(4)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,所缺步骤为趁热过滤(或38℃以上过滤)。
故答案为:趁热过滤(或38℃以上过滤);
(5)A中可能发生Na2SO3+ H2SO4(浓)= Na2SO4+SO2↑+H2O,产生的SO2被带入C中与NaOH反应生成Na2SO3,Na2SO3与H2O2反应生成Na2SO4,所以制得的NaC1O2晶体中混有Na2SO4;为减少Na2SO4产生,应尽量减少生成SO2,采取的操作可以是控制浓硫酸滴速(或缓慢滴加浓硫酸或混合固体混合物时加入过量的NaC1O3等)。
故答案为:Na2SO4;控制浓硫酸滴速(或缓慢滴加浓硫酸或混合固体混合物时加入过量的NaC1O3等)。


科目:高中化学 来源: 题型:
【题目】某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)元素B,C,D的第一电离能由大到小排列顺序为________(用元素符号表示)。
(2)D元素基态原子的最外层电子排布图为________。
(3)该配位化合物的化学式为________,配体的中心原子的杂化方式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_______________。
(5)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,分子中含有________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃将浓度均为0.1 mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100 mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图。下列说法错误的是
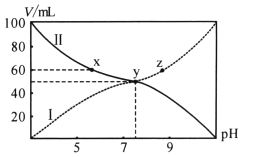
A. 曲线II表示HA溶液体积
B. x点存在c(A-)+c(OH-)=c(B+)+c(H+)
C. 电离平衡常数K(HA)>K(BOH)
D. 向z点溶液加入NaOH,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是生活中常见的有机物,能进行如下图所示的多种反应,A、C都是有机物。
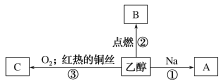
写出下列反应的化学方程式:
①______________________;
②_________________________;
③___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
氮的化合物在生产、生活中有广泛应用。
(1)氮化镓(GaN)是新型的半导体材料。基态氮原子的核外电子排布图为____;基态镓(Ga)原子的核外具有____种不同能量的电子。
(2)乙二氨的结构简式为(H2N-CH2-CH2-NH2,简写为en)。
①分子中氮原子轨道杂化类型为____;
②乙二氨可与铜离子形成配合离子[Cu(en)2]2+,其中提供孤电子对的原子是____,配合离子结构简式为____;
③乙二氨易溶于水的主要原因是____。
(3)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
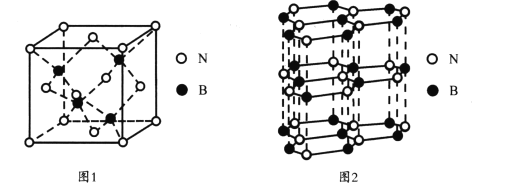
①图1中氮原子的配位数为____,离硼原子最近且等距离的硼原子有____个;
②已知六方氮化硼同层中B与N之间的距离为acm,密度为dgcm-3,则相邻层与层之间的距离为____pm(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
A(C3H6)是基本有机化工原料,由A制备聚合物C和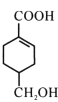 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。
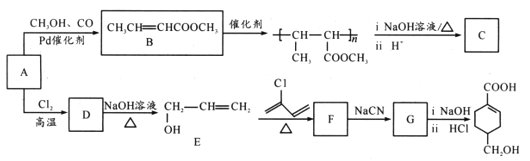
已知: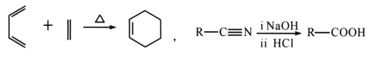
(1)A的名称是____;B中含氧官能团名称是____。
(2)C的结构简式____;D-E的反应类型为____。
(3)E-F的化学方程式为____。
(4)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是____(写出结构简式)。
(5)等物质的量的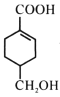 分别与足量NaOH、NaHCO3反应,消耗NaOH、NaHCO3的物质的量之比为____;检验
分别与足量NaOH、NaHCO3反应,消耗NaOH、NaHCO3的物质的量之比为____;检验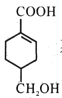 其中一种官能团的方法是____(写出官能团名称、对应试剂及现象)。
其中一种官能团的方法是____(写出官能团名称、对应试剂及现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g);正反应放热。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:
2SO3(g);正反应放热。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:
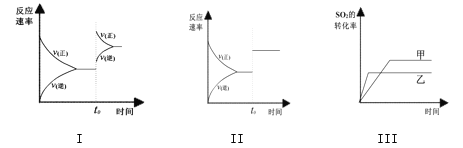
A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且甲的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硝酸的说法中正确的是( )
A.硝酸电离出的H+,能被Zn还原成H2
B.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体
D.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纳米Fe/Ni复合材料能去除污染水体的NO3,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3分两步,将步骤ii补充完整:
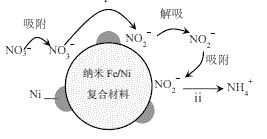
ⅰ.NO3+Fe+2H+=NO2+Fe2++H2O
ⅱ.□ +□ +□H+=□Fe2++□ +□ ______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因_________。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图1所示。(注:c0(NO3)为初始时NO3的浓度。)
①为达到最高去除率,应调水体的初始pH=______。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是_______。

(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是_____。
(5)利用电解无害化处理水体中的NO3,最终生成N2逸出。其装置及转化图如图所示:
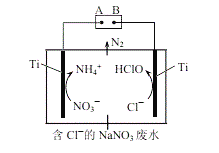
①阴极的电极反应式为___________。
②生成N2的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com