
元素X、Y的原子在化学反应中都易失去电子而形成与Ne相同的电子层结构,已
知X的原子序数比Y的原子序数大,下列说法中正确的是
| A.X的金属性比Y的金属性强 |
| B.常温下,X和Y都不能从水中置换出氢 |
| C.X元素的最高化合价比Y元素的最高化合价低 |
| D.Y元素的氢氧化物碱性比X元素的氢氧化物碱性强 |
D
解析试题分析:元素X、Y的原子在化学反应中都易失去电子而形成与Ne相同的电子层结构,这说明二者是第三周期的钠、镁或铝。已知X的原子序数比Y的原子序数大,所以X的金属性弱于Y的金属性,A不正确;如果Y是钠,常温下钠和水反应生成氢氧化钠和氢气,B不正确;X元素的最高化合价比Y元素的最高化合价高,C不正确;同周期自左向右金属性逐渐增强,最高价氧化物的水化物的碱性逐渐增强,则Y元素的氢氧化物碱性比X元素的氢氧化物碱性强,D正确,答案选D。
考点:考查元素周期表的结构和元素周期律的运用
点评:该题是高考中的常见题型,属于中等难度的试题,主要是考查学生灵活运用基础知识解决实际问题的能力的培养。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:单选题
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素A、B、C在周期表中所处的位置如表所示。A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍。则下列说法正确的是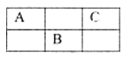
A.元素D形成的气态氢化物的分子构型一定是正四面体
B.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
C.在DB2、BC6、DC4的分子中,每个原子都满足8电子稳定结构
D.四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5 、+3、 -3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组比较中,正确的是
| A.原子半径K< Na | B.酸性H2CO3< H2SO4 |
| C.稳定性HF< HCI | D.碱性NaOH< Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
| A.原子半径:W>X>Z>Y | B.热稳定性:H2Y>HZ |
| C.离子半径:W2+>Y2- | D.碱性:XOH>W(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.周期表中的主族都有非金属元素 | B.周期表中的主族都有金属元素 |
| C.周期表中的非金属元素都位于短周期 | D.周期表中的过渡元素都是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于同位素,下列说法中正确的是
| A.质子数相同,质量数不同,化学性质几乎相同 |
| B.质子数不同,质量数相同,化学性质相同 |
| C.质子数相同,中子数相同,化学性质几乎相同 |
| D.质子数相同,质量数不同,化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
价电子总数与原子总数都相同的分子、离子或原子团称为等电子体,等电子体具有相似的结构和性质。下列选项中互称为等电子体的是
A.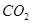 和 和 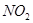 | B.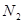 和 和  |
C.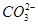 和 和 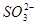 | D. 和 和 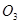 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com