
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |


科目:高中化学 来源: 题型:
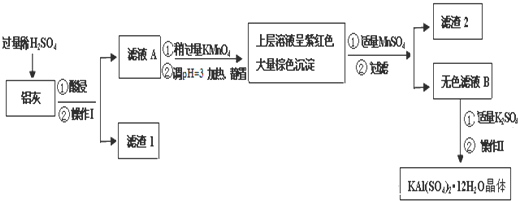
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题:
A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、CuSO4溶液中加入少量Ba(OH)2溶液:SO42-+Ba2+=BaSO4 |
| C、将Cu丝插入AgNO3溶液中:Cu+Ag+=Cu2++Ag |
| D、用小苏打NaHCO3治疗胃酸过多:HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 |
| B、食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 |
| C、保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
| D、地沟油分子中碳原子数过多,相对分子质量过大是地沟油不宜直接用作燃料油的原因之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
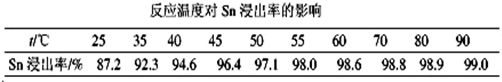
查看答案和解析>>
科目:高中化学 来源: 题型:
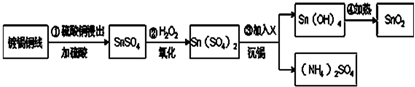
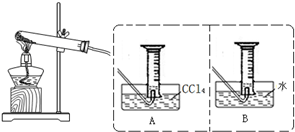 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO4->Fe3+>Br2>I2>SO2 |
| B、MnO4->Br2>Fe3+>I2>SO2 |
| C、MnO4->Br2>Fe3+>SO2>I2 |
| D、Br2>MnO4->Fe3+>I2>SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com