
【题目】烟气(主要污染物SO2、NOX)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中的SO2、NOx 的含量。
(1) O3氧化烟气中SO2、NOx 的主要反应的热化学方程式为: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃时,利用测压法在刚性反应器中,投入一定量的NO2发生反应3NO2(g)![]() 3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反应温度,则平衡后体系压强 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 时,反应物的转化率 α=______。
③T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
(3)T℃时,在体积为2L的密闭刚性容器中,投入2 mol NO2发生反应2NO2(g)![]() 2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
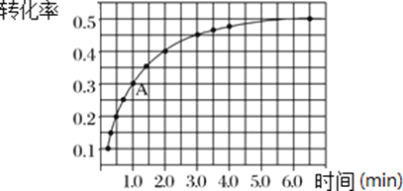
①在体积不变的刚性容器中,投入固定量的NO2发生反应,要提高NO2转化率,可采取的措施是______________、___________。
②由图中数据,求出该反应的平衡常数为_________。
③计算A 点处v正/v逆=_________________________(保留1位小数)。
【答案】+116.4 < 该反应是吸热反应,降低反应温度,平衡逆向移动,气体分子数减小,所以压强降低 45% 13.5MPa 升高温度 将生成物之一及时分离 0.25mol/L 9.1
【解析】
(1)根据盖斯定律即可求解;
(2)①根据信息可知3NO2(g)![]() 3NO(g)+O3(g),ΔH>0,该反应是吸热反应,降低反应温度,平衡逆向移动,气体分子数减小,所以压强降低;
3NO(g)+O3(g),ΔH>0,该反应是吸热反应,降低反应温度,平衡逆向移动,气体分子数减小,所以压强降低;
②根据压强之比和气体的物质的量成正比进行求解;
③根据压强之比和气体的物质的量成正比求出各物质的量,然后再根据分压等于总压乘以该气体的物质的量分数求出各物质的分压,进而求出平衡常数Kp;
(3) ①2NO2(g)![]() 2NO(g)+O2(g)的ΔH=+116.4 kJ·mol-1;要提高NO2转化率,平衡右移;
2NO(g)+O2(g)的ΔH=+116.4 kJ·mol-1;要提高NO2转化率,平衡右移;
②根据“三段式”进行求解;
③当反应达平衡时,v正= v逆,可以求出k正/k逆;然后根据反应进行到A 点处,NO2的转化率为30%,利用“三段式”进行求解。
(1)① NO(g)+O3(g)![]() NO2(g)+ O2(g)ΔH=-200.9 kJ·mol-1 ②3NO(g)+O3(g)
NO2(g)+ O2(g)ΔH=-200.9 kJ·mol-1 ②3NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1;根据盖斯定律可知,①-②可得2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1;根据盖斯定律可知,①-②可得2NO2(g)![]() 2NO(g)+O2(g)的ΔH=-200.9+317.3=+116.4 kJ·mol-1;综上所述,本题答案是:+116.4。
2NO(g)+O2(g)的ΔH=-200.9+317.3=+116.4 kJ·mol-1;综上所述,本题答案是:+116.4。
(2)①根据信息可知3NO2(g)![]() 3NO(g)+O3(g),ΔH>0,该反应是吸热反应,降低反应温度,平衡逆向移动,气体分子数减小,所以压强降低,所以则平衡后体系压强 p<24.00 MPa;综上所述,本题答案是:< ;该反应是吸热反应,降低反应温度,平衡逆向移动,气体分子数减小,所以压强降低;
3NO(g)+O3(g),ΔH>0,该反应是吸热反应,降低反应温度,平衡逆向移动,气体分子数减小,所以压强降低,所以则平衡后体系压强 p<24.00 MPa;综上所述,本题答案是:< ;该反应是吸热反应,降低反应温度,平衡逆向移动,气体分子数减小,所以压强降低;
②假设NO2的起始量为3mol,压强为20.00,15min 时,压强为23.00,则剩余气体总量x为:3/20=x/23,x=69/20mol, 设NO2的变化量为ymol,则:3-y+y+y/3=69/20, y=27/20;则反应物的转化率 α=(27/20)/3×100%=45%;综上所述,本题答案是:45%。
③假设NO2的起始量为3mol,压强为20.00,25min 时,达到平衡状态,压强为24.00,则剩余气体总量m为:3/20=m/24,m=18/5mol,设NO2的变化量为n mol,3-n+n+n/3=18/5, n=9/5;Kp(NO2)=24×(3-9/5)/ (18/5)=8, Kp(NO)= 24×(9/5)/ (18/5)=12, Kp(O3)= 24×(3/5)/ (18/5)=4,T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp= Kp(O3)×Kp3(NO)/ Kp3(NO2)=4×(3/2)3=13.5MPa ;综上所述,本题答案是:13.5MPa。
3NO(g)+O3(g)的平衡常数Kp= Kp(O3)×Kp3(NO)/ Kp3(NO2)=4×(3/2)3=13.5MPa ;综上所述,本题答案是:13.5MPa。
(3) ①2NO2(g)![]() 2NO(g)+O2(g)的ΔH=+116.4 kJ·mol-1;要提高NO2转化率,平衡右移,所以可以采用升高温度、将生成物之一及时分离等方法;综上所述,本题答案是:升高温度、将生成物之一及时分离。
2NO(g)+O2(g)的ΔH=+116.4 kJ·mol-1;要提高NO2转化率,平衡右移,所以可以采用升高温度、将生成物之一及时分离等方法;综上所述,本题答案是:升高温度、将生成物之一及时分离。
②反应在5.5min时达到平衡,NO2的转化率为50%,投入2 molNO2,变化为1mol,剩余1 molNO2,生成NO为1mol,O2为0.5mol,各物质浓度为:c(NO2)=0.5mol/L,c(NO)= 0.5mol/L,c(O2)=0.25mol,该反应的平衡常数为c2(NO)c(O2)/c2(NO2)= 0.25mol/L;综上所述,本题答案是:0.25mol/L。
③当反应达平衡时,v正= v逆,所以:k正/k逆= c2(NO)·c(O2)/c2(NO2)=K=0.25mol/L;反应进行到A 点处,NO2的转化率为30%,投入2 molNO2,变化为0.6 mol,剩余1.4 mol NO2


科目:高中化学 来源: 题型:
【题目】已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是
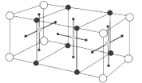
![]()
A. 1 mol该化合物中有1 mol Y B. 1 mol该化合物中有1 mol Ba
C. 1 mol该化合物中有7 mol O D. 该化合物的化学式是YBa2Cu3O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体([Al2(OH)nCl(6-n)XH2O]m)是一种高效无机水处理剂。它的制备原理是调节AlCl3溶液的pH,通过促进其水解而结晶析出。
回答下列问题:
(1)铝原子核外能量最高的电子有_____个。分析AlCl3熔点较低的原因(熔点:AlCl3—194℃,Al2O3—2054℃,NaCl—801℃)。____________________________________________________
(2)比较聚合氯化铝晶体中同周期两种元素的原子半径,并用原子结构知识说明理由。___________
(3)铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3,如果先除去铝灰中的金属氧化物杂质可选用__________(选填:“强碱”或“强酸”)。写出其中Al发生反应的离子方程式_______________________________。
(4)制备聚合氯化铝晶体,需严格控制溶液的pH在4.0~4.5才能使产率达到最大。结合AlCl3水解的离子方程式,用化学平衡移动原理解释控制pH在4.0~4.5之间的原因_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是( )
A. N2(g)![]() NO(g)
NO(g)![]() NaNO2(aq)
NaNO2(aq)
B. SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
C. Al![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3
D. Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
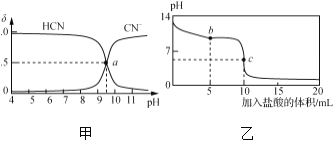
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
高温炼铜的反应之一为2CuFeS2+O2![]() Cu2S+2FeS+SO2。
Cu2S+2FeS+SO2。
(1) Cu+基态核外电子排布式为________________。

(2) Cu、Zn的第二电离能:I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(3) SO2分子中S原子的轨道杂化类型为________,分子的空间构型为________,与SO2互为等电子体的分子有________(写一种)。
(4) [Cu(CH3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为________。
(5) Fe2+、Fe3+能与CN-络合,其结构如图所示。该离子可形成铁蓝钾盐,该钾盐的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4 ]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
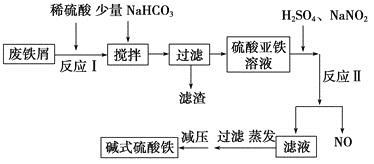
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH) 3 | Fe(OH) 2 | Al(OH) 3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3 的目的是调节溶液的pH,除去Al3+ ,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2 ,以减少NaNO2 的用量,O2 与NaNO2 在反应中均作__________。若参与反应的O2 有11.2 L(标准状况),则相当于节约NaNO2 的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+ 可部分水解生成Fe2(OH)42-,该水解反应的离子方程式为________________________________________________________________。 Fe(OH)3 的Ksp =____________。(提示,开始沉淀c(Fe 3+ )浓度为1.0×10 -5 mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+ 及NO3-。为检验所得的产品中是否含有Fe2+ ,应使用的试剂为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1000g溶剂中所含溶质的物质的量来表示的溶液浓度叫质量物质的量浓度,其单位是mol/kg。5mol/kg的硫酸的密度是1.29g/cm3,则其物质的量浓度是( )
A. 3.56mol/LB. 4.33mol/LC. 5.00mol/LD. 5.23mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com