
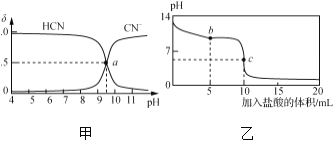
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
【答案】AD
【解析】
A. 由图可知,图甲中pH=7时,c(HCN)>c(CN-),而根据电荷守恒可以知道,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),由于c(H+)=c(OH-),则c(Na+)=c(Cl-)+c(CN-),根据物料守恒得c(Na+)= c(HCN)+ c(CN-),所以c(Cl-)=c(HCN),故A正确;
B. 图甲中的a点是HCN、CN-浓度相等,根据物料守恒得c(Na+)= c(HCN)+ c(CN-),而根据电荷守恒可以知道,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),则 c(HCN)+c(H+)=c(OH-)+c(Cl-),由图可知,此时溶液pH>7,c(H+)<c(OH-),所以c(CN-)=c(HCN)>c(Cl-),故B错误;
C. 图乙中b点时,溶液中溶质为等物质的量浓度的溶液:c(NaCN)=c(NaCl)=c(HCN),溶液呈碱性,说明CN-的水解程度大于HCN的电离程度,所以c(HCN)> c(Cl-)> c(CN-)> c(OH-)> c(H+),故C错误;
D. 图乙中c点的溶液,二者恰好完全反应,根据物料守恒得c(Cl-)= c(Na+)= c(HCN)+ c(CN-),而根据电荷守恒可以知道,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),则c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),所以D选项是正确的。
答案选AD。


科目:高中化学 来源: 题型:
【题目】某同学设计了如下实验装置,进行浓硫酸与蔗糖的反应实验。
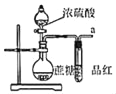
(1)实验开始时,先在烧瓶中加入15g蔗糖,并滴入几滴水使蔗糖完全湿润,然后从分液漏斗中加入15mL浓硫酸,水的作用是_________。
(2)实验中烧瓶内黑色物质疏松膨胀的原因是________(用化学方程式表示)。
(3)为了检验实验中产生的CO2,请描述接口a之后的实验操作及现象_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析图,甲、乙具有的共性是
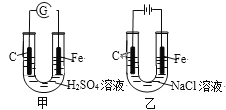
A. 反应物能量均高于生成物能量
B. 电极反应均有Fe-2e→Fe2+
C. 碳棒上均发生氧化反应
D. 溶液pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲醇燃料电池工作时,甲醇得到电子,发生还原反应
B. 室温下,稀释0.1 mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
C. 将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
D. SiO2(s)+2C(s)===Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOX)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中的SO2、NOx 的含量。
(1) O3氧化烟气中SO2、NOx 的主要反应的热化学方程式为: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃时,利用测压法在刚性反应器中,投入一定量的NO2发生反应3NO2(g)![]() 3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反应温度,则平衡后体系压强 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 时,反应物的转化率 α=______。
③T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
(3)T℃时,在体积为2L的密闭刚性容器中,投入2 mol NO2发生反应2NO2(g)![]() 2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
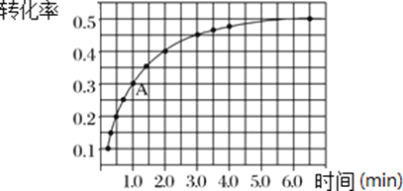
①在体积不变的刚性容器中,投入固定量的NO2发生反应,要提高NO2转化率,可采取的措施是______________、___________。
②由图中数据,求出该反应的平衡常数为_________。
③计算A 点处v正/v逆=_________________________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
8羟基喹啉(![]() )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得:
①如图所示,在三颈烧瓶中加入适量甘油、邻硝基苯酚、邻氨基苯酚和浓硫酸。
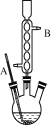
②加热至反应自动激烈进行。
③改为水蒸气蒸馏装置进行水蒸气蒸馏,直至馏出液中不再有油珠为止。
④向三颈烧瓶中加入一定量NaOH溶液后,再滴加饱和Na2CO3溶液将pH调至7~8。
⑤重新进行水蒸气蒸馏,至馏出液中不再有晶体析出。
⑥将馏出液充分冷却后抽滤,进一步精制得产品。
(1)上图中冷却水应从________(填“A”或“B”)口进。
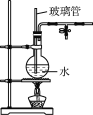
(2)上图是水蒸气发生装置。第一次水蒸气蒸馏的目的是___________________________________;当冷凝管出现堵塞时,图中可观察到的现象是_________________________________________。
(3)抽滤装置中,布氏漏斗进入抽滤瓶的部分不宜过长,其原因是________________________________。
(4)步骤②中移开火源,反应仍自动激烈进行的原因是__________________________________。
(5)步骤④中加入的饱和Na2CO3溶液不能过量的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学查阅相关资料知,氧化性:Cr2O72->Fe3+,设计了如图所示的盐桥原电池。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是
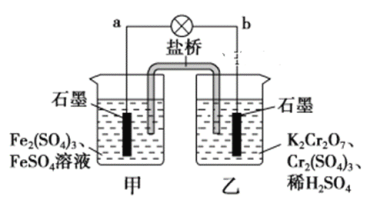
A. 甲烧杯的溶液中发生还原反应
B. 外电路的电流方向是从b到a
C. 电池工作时,盐桥中的SO42-移向乙烧杯
D. 乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-===Cr2O72-+14H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列各有机物的结构简式:
(1)当0.2 mol烃A在氧气中完全燃烧生成CO2和H2O各1.2 mol,催化加成后生成2,2二甲基丁烷,则A的结构简式为__________________________________。
(2)某炔烃与H2充分加成生成2,5-二甲基己烷,该炔烃的结构简式为________________________。
(3)某气态烃100 mL(标准状况)与含1.43 g溴的溴水恰好完全加成,生成物经测定每个碳原子上都有一个溴原子,该烃的结构简式为__________________________________。
(4)某烃1 mol与2 mol HCl完全加成,生成的氯代烃最多还可以与4 mol Cl2反应,则该烃的结构简式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com