
下列分子或离子的中心原子,带有一对孤对电子的是( )
|
| A. | XeO4 | B. | BeCl2 | C. | CH4 | D. | PCl3 |
科目:高中化学 来源: 题型:
下列关于金属及金属键的说法正确的是( )
|
| A. | 金属键具有方向性和饱和性 |
|
| B. | 金属键是金属阳离子与自由电子间的相互作用 |
|
| C. | 金属导电是因为在外加电场作用下产生自由电子 |
|
| D. | 金属具有光泽是因为金属阳离子吸收并放出可见光 |
查看答案和解析>>
科目:高中化学 来源: 题型:
、TiO2可通过下述两种方法制备金属钛:
方法一:电解TiO2来获得Ti,将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用石墨作电解槽池.
(1)阳极的电极反应式为 .
(2)电解过程中需定期更换石墨电极的原因是 .
方法二:先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.
(3)TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1该反应难以发生,原因是 .
不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4,当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使反应在高温条件下能顺利进行.
(4)已知:C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1
TiO2(s)+C(s)+2Cl2(g)=TiCl4(l)+CO2(g)△H=
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
C2H5OH+HBr→C2H5Br+H2O
主要实验步骤如下:①连接好装置,检查装置的气密性;②向烧瓶中加入一定量的苯和液溴.向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处;③将A装置中的纯铁丝小心向下插入混合液中;④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10min.
请填写下列空白:
(1)写出制取溴苯的化学方程式: .
(2)步骤③中观察到的现象是: .
(3)C装置中U形管内部用蒸馏水封住管底的作用是: .
(4)反应完毕后,U形管内的现象是: .分离溴乙烷时所用的最主要仪器的名称是(只填一种) .
(5)实验结束,从烧瓶的混合物中分离出粗制黄色的溴苯,产生黄色的原因是其中含有 (填化学式).欲得到无色的溴苯的方法是 (填试剂和操作名称).
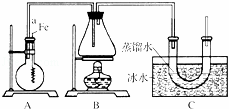
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原子轨道的说法正确的是( )
|
| A. | 凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体 |
|
| B. | CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
|
| C. | sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道 |
|
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化方式成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;②向上述稀硫酸中插入铜片,没有看到有气泡生成;③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转.下列关于以上实验设计及现象的分析,不正确的是( )
|
| A. | 实验①、②说明锌能与稀硫酸反应而铜不能 |
|
| B. | 实验③说明发生原电池反应时会加快化学反应速率 |
|
| C. | 实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
|
| D. | 实验④说明该原电池中铜为正极、锌为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
泡沫灭火机内装的药液之一是NaHCO3饱和溶液,而不选用更廉价的Na2CO3饱和溶液,其原因是( )
①质量相同的两种钠盐,NaHCO3与足量酸反应产生的CO2比Na2CO3多
②产生相同体积 (同温,同压)的CO2,消耗酸的量NaHCO3比Na2CO3少
(同温,同压)的CO2,消耗酸的量NaHCO3比Na2CO3少
③NaHCO3与酸反应比Na2CO3快得多
④NaHCO3比Na2CO3稳定,便于长期保存.
A.只有①③
B.只有②③
C.①②③
D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com