
 美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是
美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是 Al2O3+3H2↑
Al2O3+3H2↑ H2↑+O2↑
H2↑+O2↑ Al2O3+3H2↑,故正确.
Al2O3+3H2↑,故正确. Al2O3+3H2↑①,2Al2O3
Al2O3+3H2↑①,2Al2O3 4Al+3O2②,将方程式①×12+②得方程式2H2O
4Al+3O2②,将方程式①×12+②得方程式2H2O H2↑+O2↑,故D正确.
H2↑+O2↑,故D正确.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:单选题
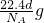
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验现象与结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol?L-1 H2SO4溶液 | 试管口出现红棕色气体.则溶液中NO3-被Fe2+还原为NO2 |
| B | 向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀.说明样品溶液中一定含有SO42- |
| C | 向0.1mol?L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热 | 红色加深.说明盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成.表明淀粉没有水解生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com