
 H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
 2CO(g)平衡常数K;
2CO(g)平衡常数K; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,| K1 |
| K2 |
| K1 |
| K2 |
| 4 |
| 9 |
| 4 |
| 9 |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 2×3 |
| 1×5 |
| 6 |
| 5 |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 1×1 |
| 2×2 |
| 1 |
| 4 |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 1×1 |
| 0.5×2 |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 2×1 |
| 3×1 |
| 2 |
| 3 |
 2CO(g)平衡常数K=
2CO(g)平衡常数K=| [c(CO)]2 |
| c(CO2) |
 CO(g)+H2(g)平衡常数K1=
CO(g)+H2(g)平衡常数K1=| c(H2)c(CO) |
| c(H2O) |
 H2(g)+CO2(g) 平衡常数K2=k=
H2(g)+CO2(g) 平衡常数K2=k=| c(H2)c(CO2) |
| c(CO)c(H2O) |
| K1 |
| K2 |
| K1 |
| K2 |
 H2O(g)
H2O(g) H2(g)
H2(g) CO2(g),
CO2(g),| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c×c |
| (0.02-c)×(0.02-c) |
| 0.015mol/L |
| 0.02mol/L |
 H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g),
CO2(g),| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 5(1-x)y×5(1-x)y |
| 5(1-x)(1-y)×5(x-y+xy) |
| 2842kJ |
| 10mol |

| 3 |
| 5 |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 4×4 |
| 6×6 |
| 4 |
| 9 |
| 4 |
| 9 |


科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| [H2]?[CO2] |
| [CO]?[H2O] |
| [H2]?[CO2] |
| [CO]?[H2O] |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 3 | 1 | 0 | 1 |
| n(H2)/mol | 2 | 1 | 0 | 1 |
| n(CO)/mol | 1 | 2 | 3 | 0.5 |
| n(H2O)/mol | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
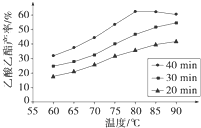 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com