

分析 (1)由图可知,压强一定时,随温度升高CO的转化率减小,说明升高温度平衡向逆反应方向移动;
温度不变,化学平衡常数不变,温度升高平衡向逆反应方向移动,平衡常数减小;
根据CO的转化率计算平衡时A中各组分物质的量,再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,A、B两点温度相同,二者平衡常数相同,结合B中CO转化率计算平衡时B中各组分物质的量,再根据平衡常数计算平衡时B容器的容积;
(2)不使用催化剂情况下,反应速率减慢,到达平衡时间变长,不影响平衡移动,平衡时CO转化率不变.
解答 解:(1)由图可知,随温度升高CO的转化率减小,说明升高温度平衡向逆反应方向移动,正反应为放热反应;
因B点与A点温度相同,K不变,对于上述反应温度升高平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC;
T1时,A点对应的α=0.5,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):10 20 0
变化量(mol):5 10 5
平衡量(mol):5 10 5
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{5}{10}}{\frac{5}{10}×(\frac{10}{10})^{2}}$=1,A、B两点温度相同,二者平衡常数相同,
B中平衡时CO转化率为0.8,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):10 20 0
变化量(mol):8 16 8
平衡量(mol):2 4 8
设平衡时B容器的容积为VL,则:$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得V=2,
故答案为:放热;KA=KB>KC;2;
(2)不使用催化剂情况下,反应速率减慢,到达平衡时间变长,不影响平衡移动,平衡时CO转化率不变,不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图: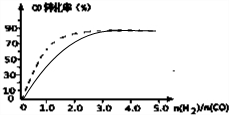 ,
,
故答案为: .
.
点评 本题考查化学平衡计算、平衡常数应用、化学平衡影响因素等,是对学生综合能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 装置缺陷和不妥之处 |
| ① | |
② | |
③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙酰水杨酸俗称阿司匹林(
乙酰水杨酸俗称阿司匹林( ),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 乙酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
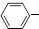 C2H5(g)?
C2H5(g)?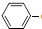 CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| C. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol•L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 ①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.
①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类化合物都具有相同的官能团 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的酯类 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com