
(12分)已知烃A完全燃烧生成CO2和H2O的物质的量相等,且其相对分子质量小于30,F是高分子化合物,E是一种有香味的物质,E中碳原子数是D的两倍。A能发生以下转化:
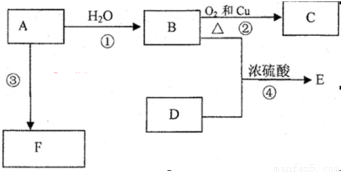
(1)A的电子式为:
(2)B中含官能团名称 ;D中含官能团名称 ;
(3)写出反应的化学方程式
②: 反应类型:
③: 反应类型:
④: 反应类型:
(1)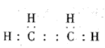
(2)羟基 羧基
(3)②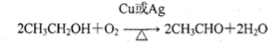 ;氧化反应;
;氧化反应;
③ ,加聚反应;
,加聚反应;
④CH3COOH+ CH3CH2OH  CH3COOCH2CH3+H2O,酯化反应
CH3COOCH2CH3+H2O,酯化反应
【解析】
试题分析:烃A完全燃烧生成CO2和H2O的物质的量相等,说明A中的C、H原子个数比是1:2,且其相对分子质量小于30,所以A的分子式是C2H4,则A是乙烯;所以B是乙醇,C是乙醛,D是乙酸,E是乙酸乙酯,F是聚乙烯。
(1)乙烯的电子式为 ;
;
(2)B是乙醇,官能团是羟基,D是乙酸,官能团是羧基;
(3)②是乙醇与氧气在铜作催化剂、加热的条件下发生氧化反应生成乙醛,化学方程式为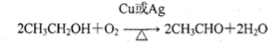 ;
;
③是乙烯发生加聚反应生成聚乙烯,化学方程式为 ;
;
④是乙醇与乙酸的酯化反应,化学方程式为CH3COOH+ CH3CH2OH  CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
。
考点:考查有机物分子式、结构式的判断,化学方程式、电子式的书写,乙醇、乙酸、乙醛的化学性质


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:填空题
切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如下:

① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
② ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na  Ni + 2NaCl。其正极反应式是_____。
Ni + 2NaCl。其正极反应式是_____。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:填空题
为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下:
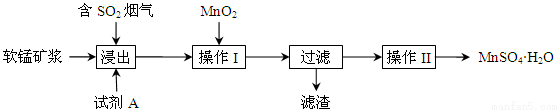
已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式: 。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将 (“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是 。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还 ,使Fe3+沉淀。检验过滤后溶液中是否含有Fe3+的操作是 。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为: 、 、洗涤、干燥。工业上为了充分利用锰元素,在流程中 可循环使用。
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为 ;MnxO4中x= 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
下列物质都具有较强的吸水性。欲使稀硝酸成为浓硝酸,不能使用的试剂是
A.浓硫酸 B.五氧化二磷 C.无水硫酸镁 D.甘油
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
吸进人体内的氧有2%转化为加速人体衰老的氧化性极强的活性氧,若Na2SeO3能清除人体内活性氧,则Na2SeO3的作用是
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于有机物的叙述中,不正确的是
A.烷烃的同系物的分子式可用通式CnH2n+2表示
B.互为同系物的有机物也互为同分异构体
C.两个同系物之间的相对分子质量差为14或14的整数倍
D.同分异构体间具有相似的化学性质
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子,(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是
A.(1)(3)(4)(7)(8) B.(1)(2)(5)(7)(9)
C.(1)(2)(5)(7)(9) D.(1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市红桥区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题。
(1)元素D在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。冶炼金属E时,用石墨做电极。E在(填“阴”或“阳”) 极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是 。
(5)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有 。土壤中含有X中的阳离子在硝化细菌的催化作用下被氧气氧化为其阴离子,写出其离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三二模考试理综化学试卷(解析版) 题型:选择题
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
A. pH=1和pH=2的盐酸,c(H+)之比为1:2
B.物质A三态间的转化如下:A(g)→A(1)→A(s),则该转化过程中△S<O
C. pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小
D. pH=9的CH3COONa溶液和pH=9的NH3.H2O溶液,两溶液中水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com