
切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如下:

① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
② ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na  Ni + 2NaCl。其正极反应式是_____。
Ni + 2NaCl。其正极反应式是_____。
(1)①放热 反应物总能量高于生成物总能量
② Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol
(2)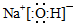 (3)B C
(3)B C
(4)① 最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强。
② NiCl2+ 2Na+ + 2e-= Ni +2NaCl
【解析】
试题分析:(1)①由于反应物的总能量比生成物的总能量高,所以发生的反应Ⅰ是放热反应。② 由题目提供的能量关系可得该反应的热化学方程式为:Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol。(2)反应Ⅱ是Na2O与水的反应,Na2O与水反应产生NaOH,反应的方程式为Na2O+H2O =2NaOH。NaOH的电子式为: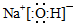 。(3)A.Na2CO3是强碱弱酸盐,在溶液中发生水解反应:Na2CO3+H2O
。(3)A.Na2CO3是强碱弱酸盐,在溶液中发生水解反应:Na2CO3+H2O NaHCO3+ NaOH。盐的水解反应是吸热反应,所以升高温度,促进盐的水解,溶液的碱性增强,溶液的pH增大。错误。B.根据电荷守恒可得c (H+)+ c (Na+)= c(OH-)+ c (HCO3-)+ 2c (CO32―);根据物料守恒可得c (Na+)= 2 c (H2CO3)+ 2c (HCO3-)+ 2c (CO32―),两式相减,整理可得c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)。正确。C.加入少量NaOH固体,由于Na+物质的量增多。c (Na+)增大,c(OH-)增大,使平衡Na2CO3+H2O
NaHCO3+ NaOH。盐的水解反应是吸热反应,所以升高温度,促进盐的水解,溶液的碱性增强,溶液的pH增大。错误。B.根据电荷守恒可得c (H+)+ c (Na+)= c(OH-)+ c (HCO3-)+ 2c (CO32―);根据物料守恒可得c (Na+)= 2 c (H2CO3)+ 2c (HCO3-)+ 2c (CO32―),两式相减,整理可得c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)。正确。C.加入少量NaOH固体,由于Na+物质的量增多。c (Na+)增大,c(OH-)增大,使平衡Na2CO3+H2O NaHCO3+ NaOH 逆向移动,所以c (CO32―)也增大。正确。D.Na2CO3=2Na++ CO32―;c (Na+) > c (CO32―);H2O+CO32-
NaHCO3+ NaOH 逆向移动,所以c (CO32―)也增大。正确。D.Na2CO3=2Na++ CO32―;c (Na+) > c (CO32―);H2O+CO32- OH-+HCO3-,所以c(OH―) > c (H+)。由于在溶液中还存在H2O
OH-+HCO3-,所以c(OH―) > c (H+)。由于在溶液中还存在H2O H++ OH―。所以c c(OH―) > (HCO3―) 。因此在溶液微粒的浓度关系为c (Na+) > c (CO32―) > c(OH―) > c (HCO3―) > c (H+)。错误。(4)①Na、Li都是第一主族的元素,由于原子半径Na>Li。原子半径越大,原子失去电子的能力就越强,因此钠比锂活泼。②由总方程式可知该电池的正极电极式为NiCl2+ 2Na+ + 2e-= Ni +2NaCl;负极的电极式为2Na-2e-=2Na+.
H++ OH―。所以c c(OH―) > (HCO3―) 。因此在溶液微粒的浓度关系为c (Na+) > c (CO32―) > c(OH―) > c (HCO3―) > c (H+)。错误。(4)①Na、Li都是第一主族的元素,由于原子半径Na>Li。原子半径越大,原子失去电子的能力就越强,因此钠比锂活泼。②由总方程式可知该电池的正极电极式为NiCl2+ 2Na+ + 2e-= Ni +2NaCl;负极的电极式为2Na-2e-=2Na+.
考点:考查物质的能量与反应热的关系、热化学方程式和物质的电子式的书写、盐的水解、离子浓度的大小比较、原电池反应原理的知识。


科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
下列与有机物的结构、性质有关的叙述正确的是
A.甲烷和氯气的反应与乙酸乙酯水解的反应属于同一类型的反应
B.蛋白质和油脂虽然都属于高分子化合物,但水解生成的产物不同
C.石油化工得到的产品均为液体,煤化工得到的产品有液体,也有固体
D.相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗氧气的物质的量多于乙烯的
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
实验:①0.1 mol·L-1 MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。
下列分析不正确的是
A.滤液b的pH=7
B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3
C.实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小
D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+ 2OH-(aq)
Mg2+(aq)+ 2OH-(aq)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
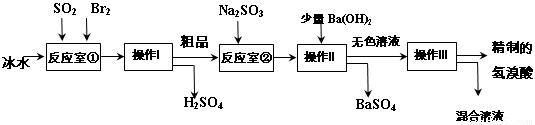
已知:Br2是易挥发、深红棕色的液体;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
(1)反应室①中发生反应的化学方程式为 。
(2)反应室①使用冰水的目的 。
(3)操作I的名称 ,操作Ⅱ用到的玻璃仪器有 。
(4)反应室②中加入Na2SO3的目的是 。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
②乙同学假设工业氢溴酸呈淡黄色是因为 ,其用于证明该假设成立的方法为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由此可知说法错误的是( )
W | X |
|
| Y | Z |
A.原子半径大小:W>X
B.元素最高正价:W>Z
C.简单阴离子的还原性:Y>Z
D.气态氢化物的稳定性:X>Y
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.植物油的主要成分是高级脂肪酸
B.银氨溶液可用于检验淀粉是否完全水解
C.溴乙烷与氢氧化钠水溶液反应可制取乙烯
D.丙氨酸(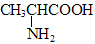 )缩聚产物的结构简式为
)缩聚产物的结构简式为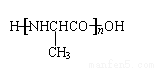
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

(1)写出步骤“还原”中可能发生反应的离子方程式 、 。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是 、 ;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是 ;
操作X是 、 (填操作名称) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述中,正确的是
A.12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3 NA
B.14g分子式CnH2n的链烃中含有的碳碳双键的数目一定为NA/n
C.标准状况下,1L液态水中含有的H+数目为10-7NA
D.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:填空题
(12分)已知烃A完全燃烧生成CO2和H2O的物质的量相等,且其相对分子质量小于30,F是高分子化合物,E是一种有香味的物质,E中碳原子数是D的两倍。A能发生以下转化:
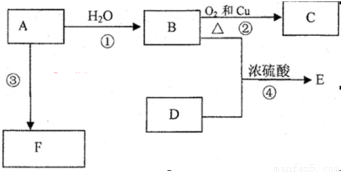
(1)A的电子式为:
(2)B中含官能团名称 ;D中含官能团名称 ;
(3)写出反应的化学方程式
②: 反应类型:
③: 反应类型:
④: 反应类型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com