
| A. | Na Mg Al | B. | Na O F | C. | P Si Al | D. | C Si P |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,一般电子层越多原子半径越大.
解答 解:A.Na、Mg、Al同周期,自左而右原子半径减小,故原子半径:Na>Mg>Al,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>O>F,故B错误;
C.P、Si、Al同周期,随原子序数增大原子半径减小,故原子半径:P<Si<Al,故C正确;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,一般电子层越多原子半径越大,故原子半径:C<P<Si,故D错误.
故选:C.
点评 本题考查微粒半径半径,比较基础,注意理解同周期、同主族原子半径变化规律,识记Cl原子半径在第二周期主族元素原子半径所处位置、Li原子半径在第三周期主族元素中原子半径位置.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:| 滴定次数 | 待测液 体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 假设 | 推断 | |
| A | 若X、Y均能发生消去反应 | Z一定能发生消去反应 |
| B | 若X是白酒的主要成分 | Y可能是丙三醇 |
| C | 若X、Y分子中分别有1个、2个碳原子 | Z的摩尔质量不小于60 g•mol-1 |
| D | 若X、Y均存在醇类同分异构体 | Z一定存在醇类同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷 | |
| D. | 由乙烯制聚乙烯;由1,3-丁二烯合成顺丁橡胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
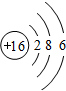 ,G元素形成的单质的结构式为Cl-Cl.
,G元素形成的单质的结构式为Cl-Cl. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
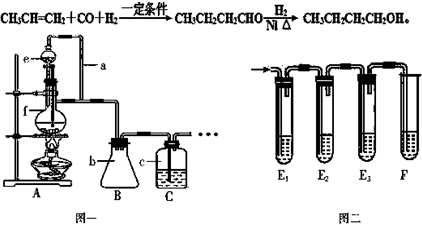

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com