
| 假设 | 推断 | |
| A | 若X、Y均能发生消去反应 | Z一定能发生消去反应 |
| B | 若X是白酒的主要成分 | Y可能是丙三醇 |
| C | 若X、Y分子中分别有1个、2个碳原子 | Z的摩尔质量不小于60 g•mol-1 |
| D | 若X、Y均存在醇类同分异构体 | Z一定存在醇类同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.只有连接醇羟基碳原子相邻碳原子上含有H原子的醇能发生消去反应;
B.乙醇和丙三醇结构不相似;
C.Y分子中2个碳原子,式量最小为乙醇,则Z为丙醇;
D.若X、Y均存在醇类同分异构体,Z不一定含有同分异构体.
解答 解:A.X、Y、Z 三种醇互为同系物,如丙醇、乙醇、甲醇,丙醇、乙醇能发生消去反应,甲醇CH3OH,-OH相连碳没有相邻碳,无法发生消去反应,故A错误;
B.乙醇含有1个醇羟基、丙三醇含有3个醇羟基,所以乙醇和丙三醇结构不相似,二者不是同系物,故B错误;
C.X、Y、Z 三种醇互为同系物,X、Y分子中分别含有1个、2个碳原子,Y分子中2个碳原子,式量最小为乙醇,则Z为丙醇,其摩尔质量等于60g.mol-1,若Y为乙二醇,则Z为丙二醇,摩尔质量大于60g.mol-1,故C正确;
D.X、Y、Z 三种醇互为同系物,如丁醇、戊醇、乙醇,乙醇不存在醇类同分异构体,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确醇发生消去反应结构特点、同分异构体判断方法是解本题关键,采用举例法分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 丙醇与乙酸的反应条件通常是浓硫酸、加热 | |
| B. | 充分反应可以生成1mol乙酸乙酯 | |
| C. | 生成的乙酸丙酯和水的物质的量之比是1:2 | |
| D. | 反应结束时,剩余2mol乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
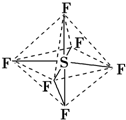
| A. | 六氟化硫中各原子均为8电子稳定结构 | |
| B. | 六氟化硫易燃烧生成二氧化硫 | |
| C. | 六氟化硫分子中含极性键、非极性键 | |
| D. | S-F键是σ键,且键长、键能都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢键存在于分子之间,不存在于分子之内 | |
| B. | 对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 冰熔化时只破坏分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能转化为化学能 | |
| B. | 铂电极上发生的反应为:H2-2e-=2H+ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着核电荷数增加,碱金属单质的密度逐渐增大 | |
| B. | 随着核电荷数增加,卤素单质的熔沸点逐渐降低 | |
| C. | 随着核电荷数的增加,碱金属单质与水反应的剧烈程度增大 | |
| D. | 随着核电荷数增加,碱金属离子的氧化性逐渐增强,卤素离子的还原性逐渐减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com