
【题目】已知A是用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图所示的转化关系,请回答下列问题:

(1)A中官能团的名称为___,B中官能团的电子式为__。
(2)在F的同系物中最简单的有机物的空间构型为__。
(3)写出与F互为同系物的含5个碳原子的有机物的所有同分异构体中,其中一氯代物种类最少的同分异构体的结构简式:___。
(4)写出下列编号对应反应的化学方程式,并注明反应类型:
②___,___;
④___,___。
【答案】碳碳双键 ![]() 正四面体形 C(CH3)4 2CH3CH2OH+O2
正四面体形 C(CH3)4 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH
2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 取代反应(或酯化反应)
CH3COOCH2CH3+H2O 取代反应(或酯化反应)
【解析】
已知A是用来衡量一个国家石油化工发展水平的标志性物质,则A为乙烯,A与水反应生成B(乙醇),B催化氧化生成C(乙醛),乙醛催化氧化生成D(乙酸),乙醇和乙酸反应生成E(乙酸乙酯),A和氢气反应生成F(乙烷),A和HCl反应生成氯乙烷。
⑴A是乙烯,含中官能团的名称为碳碳双键,B为乙醇,官能团为羟基,其电子式为![]() ;故答案为:碳碳双键;
;故答案为:碳碳双键;![]() 。
。
⑵F为乙烷,其同系物中最简单的有机物是甲烷,甲烷的空间构型为整四面体形,故答案为:正四面体形。
⑶F为乙烷,与乙烷互为同系物的含5个碳原子的有机物的分子式为C5H12,其同分异构体为正戊烷、异戊烷、新戊烷,一氯代物种类最少的同分异构体为新戊烷,其结构简式为C(CH3)4;故答案为:C(CH3)4。
⑷②是乙醇的催化氧化反应生成乙醛,反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应类型为氧化反应;故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,反应类型为氧化反应;故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;氧化反应。
2CH3CHO+2H2O;氧化反应。
④是乙醇和乙酸发生酯化反应生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,反应类型为取代反应(或酯化反应);故答案为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,反应类型为取代反应(或酯化反应);故答案为:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;取代反应(或酯化反应)。
CH3COOCH2CH3+H2O;取代反应(或酯化反应)。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C. ![]() 分子中每个原子均满足8电子稳定结构
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1硫酸溶液中,乙同学将电极放入6 mol·L-1的氢氧化钠溶液中,如下图所示。
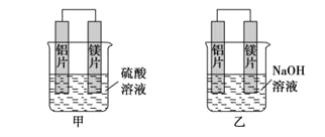
(1)写出甲池中正极的电极反应式_______________________________________。
(2)写出乙池中负极的电极反应式________________________________________。
(3)写出乙池中总反应的离子方程式_______________________________________。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确(____)
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案________________(如可靠,此空可不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
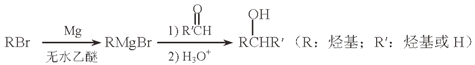
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)草酸与酸性高锰酸钾的反应的离子方程式为:__________________________________
(2)实验①②结论是___________________________________________________________。
(3)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(4)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为________。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(5)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(6))若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(7)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_____mg·kg-1(计算结果保留整数即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向恒容密闭容器中充入1molN2与4molH2,发生化学反应N2(g)+3H2(g)![]() 2NH3(g),当反应达到最大限度时,下列说法正确的是( )
2NH3(g),当反应达到最大限度时,下列说法正确的是( )
A.V(N2)=V(NH3)
B.单位时间内,断裂1molN![]() N,同时断裂2molN-H
N,同时断裂2molN-H
C.此时,容器内气体的平均摩尔质量不再变化
D.此时,该反应不一定达到了化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可以证明一水合氨是弱电解质的是
①室温下,![]() 的氨水可以使酚酞试液变红②室温下,
的氨水可以使酚酞试液变红②室温下,![]() 的氯化铵溶液的PH约为5
的氯化铵溶液的PH约为5
③在相同条件下,氨水溶液的导电性比强碱溶液弱④铵盐受热易分解
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积的0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液混合得到浊液,过滤后进行如下实验:
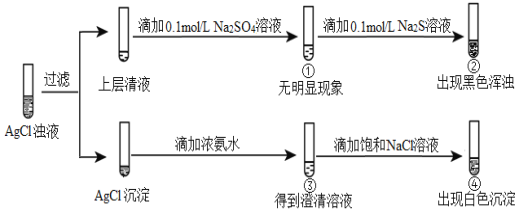
下列分析不正确的是
A. ①的现象说明上层清液中不含Ag+
B. ②的现象说明该温度下Ag2S比Ag2SO4更难溶
C. ③中生成Ag(NH3)2+,促进AgCl(s)溶解平衡正向移动
D. 若向③中滴加一定量的硝酸,也可以出现白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com