
【题目】下列说法正确的是( )
A.H+和S2-的最外电子层都形成了8个电子的稳定结构
B.C60和金刚石都是原子间通过共价键结合形成的原子晶体
C.Na和H2O混合时放出热量与微粒之间的作用力有关
D.H2O2易分解是因为H2O2分子间作用力弱
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
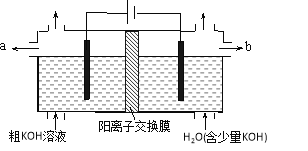
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是
CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是

A.T1>T2,该反应的△H>0
B.加入催化剂可以提高CO的转化率
C.T1时的平衡常数时的平衡常数K1>T2时的平衡常数K2
D.温度降低,CO(g)+2H2(g)![]() CH3OH(I)的△H值将变大
CH3OH(I)的△H值将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图硬质玻璃管A中放入干燥的细铜丝,左方烧杯中盛有温水,试管B中盛有甲醇,试管C中盛有冷水。向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝。
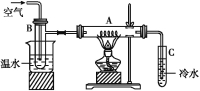
(1)撤去A处酒精灯后铜丝仍然能保持红热的原因是___________________
(2)反应后将试管C中的液体冷却,取出少量,倒入新制的Cu(OH)2,加热到沸腾可观察到的现象是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机材料中间体。实验室由芳香化合物A制备H的一种合成路线如下;

已知:①![]()
②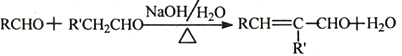
③![]()
请回答下列问题:
(1)芳香族化合物B的名称为__________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由F生成G的第①步反应类型为_______________。
(3)X的结构简式为_______________。
(4)写出D生成E的第①步反应化学方程式____________________________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有__________种,写出其中任意一种的结构简式_____________________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2
②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。
(6)写出用 为原料制备化合物
为原料制备化合物 的合成路线,其它无机试剂任选_____________________________________________。
的合成路线,其它无机试剂任选_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:Mo基催化剂的耐硫甲烷化反应会涉及WGS 或者RWGS 反应,主要反应式如下:
(1)CO和CO2甲烷化 CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH1=-206.2kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH2=-165.0kJ/mol
写出CO 与水蒸气反应生成CO2和H2的热化学方程式__________________________________。
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 ,
,
①该反应的ΔH__________0 (选填“<”、“>”或“=”)。
②在500℃条件下达平衡时CO 的转化率为______________________。
③计算在300℃条件下达平衡时K=________________________。
④将容器d 中的平衡状态转变到容器c中的平衡状态,可采取的措施有______________________。
Ⅱ:某电解装置如图所示,X、Y 均为惰性电极:
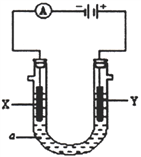
(3)若a溶液为滴有酚酞试液的NaNO3溶液,通电一段时间后X 电极及周围溶液的现象是:________________________________,Y 电极的电极反应式为______________________。
(4)若a 溶液为饱和CuCl2溶液,当电路中有0.2 mol 的电子通过时,阴、阳两电极的质量之差是__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,AgCl 与AgI的饱和溶液中存在如下关系,下列说法正确的是
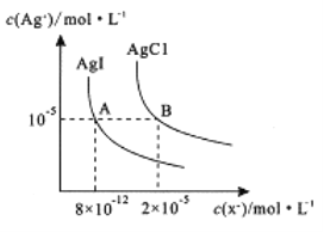
A. AgCl(s) +I-(aq)![]() AgI(s) +Cl-(aq),在该温度下的平衡常数K=2.5×106
AgI(s) +Cl-(aq),在该温度下的平衡常数K=2.5×106
B. 向0.1mol/LKI溶液中加入AgNO3 溶液,当I-刚好完全沉淀时,c(Ag+ )=2×10-12mol/L
C. 向AgCl、AgI的饱和溶液中加入氢碘酸溶液,可使溶液由A点变到B点
D. 向2 mL0.01mol/LAgNO3,溶液中加几滴0.01mol/L NaC1溶液,静置片刻,再向溶液中加几滴0.01mol/LKI溶液,有黄色沉淀生成,说明Ksp(AgCl)>Ksp(AgI)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com