
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。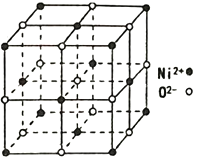
【答案】 3d84s2 23 6 O sp3 sp2 分子晶体 O>C>Ni 2:1 正八面体 ![]()
【解析】试题分析:本题考查物质结构与性质,涉及价层电子排布式的书写,电负性的比较,原子杂化方式的判断,σ键和π键的判断,配位化合物,晶体类型的判断,晶胞的分析和计算。
(1)Ni的原子序数为28,基态Ni原子核外有28个电子,根据构造原理,基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2,价层电子排布式为3d84s2。Fe原子核外有26个电子,Fe3+核外有23个电子,每个电子的运动状态都不相同,基态Fe3+有23种不同运动状态的电子。基态Cr原子核外有24个电子,基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,3d上5个电子和4s上的1个电子为未成对电子,基态Cr原子有6个未成对电子。
(2)配合物[Cr(H2O)6]3+中,中心离子为Cr3+,配体为H2O,Cr3+具有空轨道,H2O中O原子上有孤电子对,O原子提供孤电子对与Cr3+形成配位键,与Cr3+形成配位键的原子是O。CH3CHO中—CH3中碳原子形成4个共价单键,—CH3中碳原子为sp3杂化,—CHO中碳原子形成1个碳氧双键和2个单键,—CHO中碳原子为sp2杂化。
(3)由于Ni(CO)4常温下是无色液体,易溶于有机溶剂,Ni(CO)4是分子晶体。非金属性O![]() C
C![]() Ni,元素的非金属性越强,元素的电负性越大,组成Ni(CO)4三种元素电负性由大到小的顺序为O
Ni,元素的非金属性越强,元素的电负性越大,组成Ni(CO)4三种元素电负性由大到小的顺序为O![]() C
C![]() Ni。CO的结构式为C
Ni。CO的结构式为C![]() O,三键中有1个σ键和2个π键,CO分子中π键与σ键的个数比为2:1。
O,三键中有1个σ键和2个π键,CO分子中π键与σ键的个数比为2:1。
(4)根据NiO的立方晶体结构知,O2-周围等距离最近的Ni2+有6个,6个Ni2+构成正八面体,O2-填入Ni2+构成的正八面体空隙。用“均摊法”,晶胞中含Ni2+:8![]() +6
+6![]() =4,含O2-:12
=4,含O2-:12![]() +1=4;晶胞中原子的体积为4
+1=4;晶胞中原子的体积为4![]() π(r1
π(r1![]() 10-10cm)3+4
10-10cm)3+4![]() π(r2
π(r2![]() 10-10cm)3=4
10-10cm)3=4![]() π(r13+r23)
π(r13+r23)![]() 10-30cm3;1mol晶体的质量为75g,1mol晶体的体积为
10-30cm3;1mol晶体的质量为75g,1mol晶体的体积为![]() cm3,晶胞的体积为4
cm3,晶胞的体积为4![]() cm3;该晶胞中原子的体积占晶胞体积的百分率为4
cm3;该晶胞中原子的体积占晶胞体积的百分率为4![]() π(r13+r23)
π(r13+r23)![]() 10-30cm3
10-30cm3![]() (4
(4![]() cm3)
cm3)![]() 100%=
100%=![]()
![]() 100%。
100%。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】关于如图所示装置的说法错误的是( )
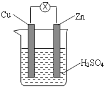
A. 锌片发生氧化反应
B. 铜片周围溶液变为蓝色
C. 电子由锌片通过外电路流向铜片
D. 溶液中SO42-向负极方向流动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、 Al2O3、MgO、CaO等杂质) 制备钴的氧化物,其制备工艺流程如下:
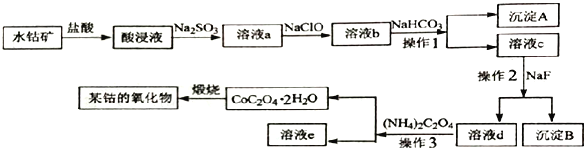
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写一种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______________________________。
(3)溶液a中加入NaClO的作用为_______________________________。
(4)沉淀A 的成分为__________________。操作2的名称是___________________。
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5moI/L,此时溶液中c(Ca2+)最大等于_________mol·L-1。
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H+和S2-的最外电子层都形成了8个电子的稳定结构
B.C60和金刚石都是原子间通过共价键结合形成的原子晶体
C.Na和H2O混合时放出热量与微粒之间的作用力有关
D.H2O2易分解是因为H2O2分子间作用力弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B ![]() C(g)+D 中,A、C都是无色气体,当达到平衡时,下列叙述错误的是
C(g)+D 中,A、C都是无色气体,当达到平衡时,下列叙述错误的是
A. 若增大A的浓度,平衡体系颜色加深,说明D是有颜色的气体
B. 增大压强,平衡不移动,说明B、D必是气体
C. 若B是气体,增大A的浓度会使B的转化率增大
D. 升温,C的质量分数减小,说明正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国首艘使用了钛合金材料的国产航母下水。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图,下列说法错误的是
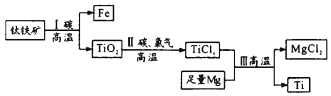
A. 步骤I中碳作还原剂
B. 步骤II中未发生氧化还原反应
C. 步骤III需在氩气环境中进行,防止金属被空气氧化
D. 可用稀硫酸除去金属钛中的少量镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com