
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(溶剂不变),发生如下反应:3A(g)+B(g)⇌xC(g)2min时反应达到平衡状态(温度不变),剩余0.8molB,并测定C的浓度为0.4mol/L,请填写下列空白:
(1)从开始至达到平衡的状态,生成C平均反应速度为 .
(2)x=4;平衡常数K= .
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母) ;
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动.
考点: 化学平衡常数的含义;化学平衡的影响因素.
专题: 化学平衡专题.
分析: 依据化学平衡三段式列式计算,平衡状态并测定C的浓度为0.4mol/L,物质的量为0.8mol
3A(g)+B(g)⇌xC(g)
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.2x
平衡量(mol) 2.4 0.8 0.8
0.2x=0.8
x=4
依据平衡计算结果分析计算反应速率,平衡常数,结合平衡移动原理分析判断平衡移动方向.
解答: 解:平衡状态并测定C的浓度为0.4mol/L,物质的量为0.8mol,则
3A(g)+B(g)⇌xC(g)
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.2x
平衡量(mol) 2.4 0.8 0.8
0.2x=0.8
x=4
(1)从开始至达到平衡的状态,生成C平均反应速度=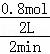 =0.2mol/L•min,故答案为:0.2mol/L•min;
=0.2mol/L•min,故答案为:0.2mol/L•min;
(2)上述计算可知x=4,平衡常数K=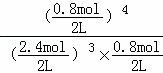 =
=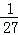 ,故答案为:4;
,故答案为:4;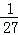 ;
;
(3)若继续向原混合物的容器中通入少量氦气,恒温恒容容器,加入惰气总压增大,分压不变,平衡不动,故答案为:C.
点评: 本题考查了化学反应速率,平衡常数概念计算的分析应用,主要是计算方法和平衡移动原理的理解,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。回答下列问题:
(1)C、D、E三种元素的简单离子按半径由小到大的顺序为(用离子符号表示)______________。
(2)元素B与D的电负性的大小关系是___________,
(3)C与E的第一电离能的大小关系是___________,(填﹥、﹤、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子构型____________________。
(5)C的氧化物溶于NaOH中的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中,△H能正确表示物质的燃烧热的是()
A. CO(g)+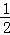 O2(g)═CO2(g);△H=﹣283.0 kJ/mol
O2(g)═CO2(g);△H=﹣283.0 kJ/mol
B. C(s)+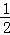 O2(g)═CO(g);△H=﹣110.5 kJ/mol
O2(g)═CO(g);△H=﹣110.5 kJ/mol
C. H2(g)+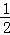 O2(g)═H2O(g);△H=﹣241.8 kJ/mol
O2(g)═H2O(g);△H=﹣241.8 kJ/mol
D. 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的装置,C、D、E、F均为惰性电极.将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:(1)电极A是正极填“正极”或“负极”)
(2)甲装置中C极的电极反应式为.
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,所得溶液在25℃时的pH=.
(4)欲用丙装置给铜镀银,G应该是银(填“铜”或“银”),电镀液的主要成分是(填化学式).

查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素R、T、X、Y、Z在元素周期表的相对位置如表,它们的最外层电子数之和为24.则下列判断正确的是()
R T
X Y Z
A. X位于元素周期表中第三周期第ⅥA族
B. Z元素的气态氢化物为极性分子
C. Y元素最高价氧化物对应水化物为强酸
D. 五种元素中原子半径最大的是R
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或记录正确的是 ( )
A.用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.用两只250 mL的容量瓶配制0.1 mol·L-1500 mLNaOH溶液
D.常温常压下测得1 mol N2的质量为28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C2H6O的化合物A具有如下性质:
A+Na―→慢慢产生气泡 A+CH3COOH 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是( )。
A.一定含有—OH B.一定含有—COOH
C.A为乙醇 D.A为乙酸
(2)含A的体积分数为75%的水溶液可以用作_______________________
(3)A与钠反应的化学方程式:
(4)化合物A和CH3COOH反应生成的有香味的产物的结构简式为________。
(5)A可由含淀粉的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式:______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
有一包白色粉末,其中可能含有NaNO3、CaCl2、K2CO3.现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成;②向①的悬浊液中加入过量稀硝酸,振荡,白色沉淀消失并有气泡产生;③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成.
根据上述实验现象,完成下列各题:
(1)原白色粉末中肯定含有的物质为 ,可能含有的物质为 .
(2)写出步骤①中发生反应的化学方程式 .
(3)写出步骤②中发生反应的离子方程式为 .
(4)写出步骤③中发生反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com