
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
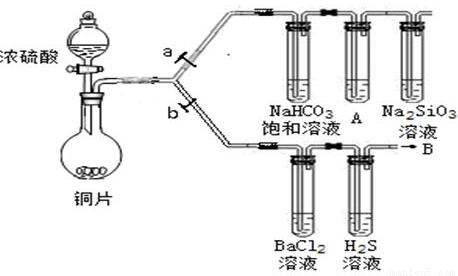
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
|
滴加的溶液 |
氯水 |
氨水 |
|
沉淀的化学式 |
|
|
写出其中SO2显示还原性并生成沉淀的离子方程式__________________________________。
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。
试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。
科目:高中化学 来源: 题型:
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
|
|
写出其中SO2显示还原性并生成沉淀的离子方程式__________________________________。
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。
试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2011--2012学年四川省成都二十中高二上学期期中考试化学试卷 题型:填空题
(12分)根据要求完成下列问题:
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、 B、 C、
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:_________、__________、_________。
(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是 ,由非极性键形成的非极性分子是 ,能形成分子晶体的化合物是 ,含有氢键的晶体的化学式 ,属于原子晶体的是 ,四种物质熔点由高到低的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2012届北京四中高三上学期期中测试化学试卷 题型:实验题
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
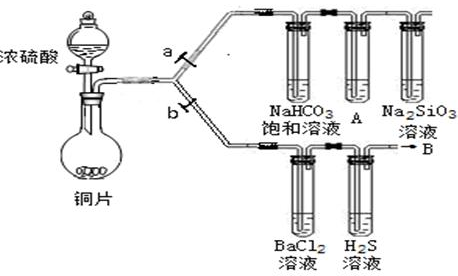
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第二次月考化学试卷(解析版) 题型:计算题
(13分)按要求完成下列各小题。
(1)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)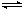 CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
|
化学键 |
C-C |
C-H |
H-H |
C-O |
C=O |
H-O |
|
键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
750 |
463 |
计算反应上述反应的焓变△H=_______________________
写出上述反应的平衡常数表达式K=__________________,若升高温度,则平衡常数K________(填“增大”或“减小”或“不变”)。该反应的△S______0(填“>”或“<”或“=”),在 _________(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(3)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(4)在25℃时,将cmol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com